题目内容
工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生反应的电极反应式:阴极:______________ 。阳极:______________ 。
(2)写出Cr2O72-变为Cr3+离子方程式:_______________________ 。
(3)废水由酸性变为碱性的原因是_____________________________ 。
(4)________(填“能”或“不能”)改用石墨电极,原因是_________________ 。
(1)两极发生反应的电极反应式:阴极:______________ 。阳极:______________ 。
(2)写出Cr2O72-变为Cr3+离子方程式:_______________________ 。
(3)废水由酸性变为碱性的原因是_____________________________ 。
(4)________(填“能”或“不能”)改用石墨电极,原因是_________________ 。
(1)Fe―2e-=Fe2+;2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O
(3)H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液酸性变为中性,再由中性变为碱性,Cr3++3OH-=Cr(OH)3↓, Fe3++OH-=Fe(OH)3↓
(4)不能;若改用石墨电极,阴极产物为Cl2,而不是Fe2+,没有Fe2+的还原作用, Cr2O72-就不能变为Cr3+,也就不能转化成Cr(OH)3沉淀而被除去。

练习册系列答案
相关题目
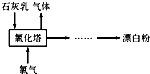 氯气是重要的化工原料.
氯气是重要的化工原料.