题目内容
8.某反应体系的物质有NaOH、Au2O3、Na2S4S6、Na2S2O3、Au2O、H2O.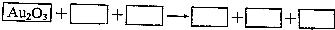
(1)请将Au2O3之外反应物与生成物分别填入以上空格内.
(2)反应中,被还原的元素是+3价的Au元素,还原剂是Na2S2O3.
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数自.

分析 (1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,根据元素守恒配平其它物质的系数;
(2)Au元素的化合价降低,被还原;S元素的化合价升高;
(3)氧化剂为Au2O3,还原剂为Na2S2O3,该反应转移4e-.
解答 解:(1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,根据Au守恒可知Au2O系数为1,根据硫元素守恒可知Na2S2O3系数为4,根据元素Na元素守恒可知NaOH的系数为4,根据H元素守恒可知H2O系数为2,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH,
故答案为:Na2S2O3;H2O;Au2O;Na2S4O6;NaOH.
(2)Au元素的化合价降低,则+3价的Au元素被还原;S元素的化合价升高,则Na2S2O3为还原剂,故答案为:+3价的Au元素;Na2S2O3;
(3)氧化剂为Au2O3,还原剂为Na2S2O3,该反应转移4e-,则电子转移的方向和数目可表示为 ,
,
故答案为: ;
;
点评 本题考查氧化还原反应的配平、基本概念等,为高频考点,侧重于学生的分析能力的考查,难度中等,根据化合价、元素守恒判断反应物、生成物是解题的关键.掌握化合价升降法配平氧化还原反应方程式.

 阅读快车系列答案
阅读快车系列答案| A. | 吸热反应 | B. | 离子反应 | C. | 复分解反应 | D. | 非氧化还原反应 |
| A. | 少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出):3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓ | |
| C. | 向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ | |
| D. | 向碳酸氢钙溶液中加入少量KOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| A. |  | B. |  | C. |  | D. |  |
| A. | H+、Ca2+、Cl-、CO32- | B. | Cl-、ClO-、K+、H+ | ||
| C. | Na+、Fe3+、SO42-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
| A. | 将钢片插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 稀硫酸与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加醋酸:SiO32-+2H+=H2SiO3↓ |
| A. | 氯酸钾溶液与二氧化锰反应制氧气 | B. | 浓氨水与氢氧化钙固体制氨气 | ||
| C. | 乙醇和浓硫酸(170℃)制乙烯 | D. | 铜和浓硝酸制二氧化氮 |
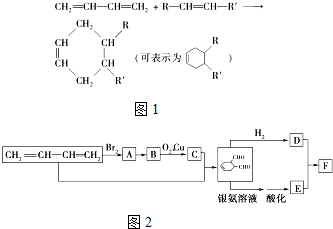
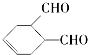 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
. 、HC≡CCOOCH3.
、HC≡CCOOCH3.