题目内容
5.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关化学物质引起的.下列环境问题与所对应的化学物质不相符的是( )| A. | 臭氧层破坏--氟氯烃 | B. | 光化学烟雾--氮氧化物 | ||
| C. | 水体富营养化--含磷洗衣粉 | D. | 酸雨--二氧化碳 |
分析 A.氟利昂破坏臭氧层;
B.二氧化氮能造成光化学烟雾;
C.水体富营养化是水中含有过量营养物质(主要是指氮、磷等),引起各种水生生物、植物异常繁殖和生长的现象;
D.雨水中溶解二氧化硫形成酸雨.
解答 解:A.氟利昂破坏臭氧层,导致臭氧空洞,则N2与含氟化合物的排放无关,故A正确;
B.二氧化氮能造成光化学烟雾,所以光化学烟雾与氮的氧化物有关,故B正确;
C.水中含有过量营养物质(主要是指氮、磷等)造成水体富营养化,则水体富营养化与含磷洗涤剂有关,故C正确;
D.因雨水中溶解二氧化硫形成酸雨,使雨水pH<5.6,所以酸雨与二氧化碳无关,故D错误.
故选D.
点评 本题考查常见的环境污染问题,明确酸雨、光化学烟雾、臭氧空洞、水体富营养化等几大环境问题即可解答,题目较简单.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
13.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
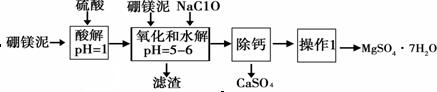
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤蒸发浓缩、趁热过滤.
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.

根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
20.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质硼 | |
| 熔点/℃ | 810 | 710 | 180 | -68 | 2300 |
| 沸点/℃ | 1 465 | 1 418 | 160 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质硼可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl的键的强度比MgCl2的小 |
10.某元素X的最高价氧化物的化学式为X2O5,则它的气态氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
17.下列事实中,不能作为元素金属性和非金属性强弱判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
14.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
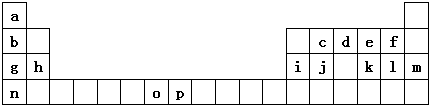
试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.

试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.
15.按Si、P、S、Cl的顺序递增排列的是( )
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
 .
. ,Y的结构式为
,Y的结构式为 .
.