题目内容
12.工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应.现将2mol SO2、1mol O2充入一密闭容器充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )| A. | 2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(g)△H=-98.3 kJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=+98.3 kJ•mol-1 | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-196.6 kJ•mol-1 |
分析 SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应.现将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%,所以反应的SO2的物质的量为1mol,因为反应是可逆反应,发生反应的二氧化硫为1mol,放热为98.3KJ,所以依据反应放出的热量,结合热化学方程式的书写方法来解答,注意标注物质的聚集状态.
解答 解:将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%,所以反应的SO2的物质的量为1mol,因为反应是可逆反应,发生反应的二氧化硫为1mol,放热为98.3KJ,热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ•mol-1或SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1;
A、选项中的热化学方程式符合题意,故A正确;
B、选项中的热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;
C、反应是放热反应,故C错误;
D、选项中的热化学方程式中反应热和对应二氧化硫的量不符合,故D错误;
故选A.
点评 本题考查了热化学方程式的含义和注意问题,注意反应是可逆反应,不能进行彻底,题目较简单.

练习册系列答案
相关题目
7.心脏起搏器一般是给心跳缓慢的病人使用.某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2═4LiCl+S+SO2下列有关判断正确的是( )
| A. | 还原剂只有锂 | |
| B. | 标准状况下生成1.12LSO2时,反应转移电子为0.1mol | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | SOCl2中既有离子键,也有共价键 |
17.制取CH3CH2Cl最好的方法是( )
| A. | 乙烷与氯气反应 | B. | 乙烯与氯气反应 | C. | 乙烷与HCl反应 | D. | 乙烯与HCl反应 |
1.下列热化学方程式中△H表示可燃物燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H═-571.6kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-802.3kJ•mol-1 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 |
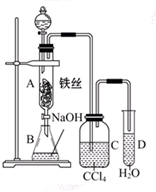 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
 与
与 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); 和
和 ;⑧
;⑧ 和
和  ;
; 2,4-二甲基-3-乙基己烷
2,4-二甲基-3-乙基己烷 .该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为
.该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为 和
和 .
.