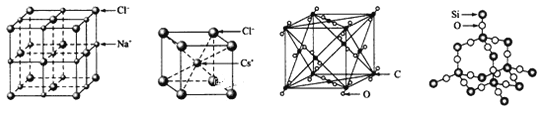
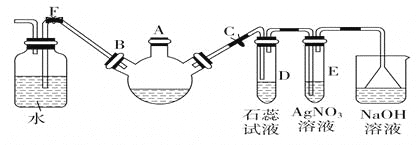
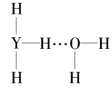
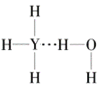
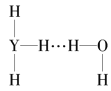题目内容
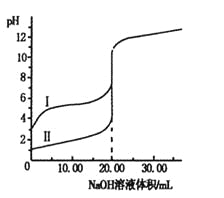
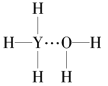
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
【答案】D
【解析】
A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关;
B.可逆反应中的各种微粒都共存;
C.只要不破坏氨分子的电离平衡,液氨中存在c(NH4+)=c(NH2-);
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3。
A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中c(NH4+)与c(NH2-)的乘积为定值,A正确;
B.液氨电离中存在电离平衡,所以液氨中含有 NH3、NH4+、NH2-粒子,B正确;
C.根据2NH3![]() NH4++NH2-可知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,C正确;
NH4++NH2-可知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,C正确;
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3,所以液氨的电离达到平衡时,c(NH3)>c(NH4+)=c(NH2-),D错误;
故合理选项是D。

【题目】市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量 | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式![]() 将化学计量数填于空白处
将化学计量数填于空白处![]()
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]()
(2)已知:![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
![]() 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
![]() 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
![]() 以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
![]() 判断c中反应恰好完全依据的现象是 ______ .
判断c中反应恰好完全依据的现象是 ______ .
![]() 根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.
根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.