题目内容
11.下述叙述中正确的是( )| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5×6.02×1023个 | |
| B. | 36.5g氯化氢中含有6.02×1023个氢离子 | |
| C. | 7.8gNa2O2与足量的水反应,转移的电子数为0.2×6.02×1023 | |
| D. | 标准状况下,2.24L CO2和SO2混合物中所含有的原子数为0.3×6.02×1023 |
分析 A、标况下四氯化碳 为液体;
B、HCl为共价化合物;
C、求出过氧化钠的物质的量,然后根据过氧化钠和水的反应为歧化反应来分析;
D、求出混合物的物质的量,然后根据二氧化碳和二氧化硫均为三原子分子来分析.
解答 解:A、标况下四氯化碳 为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、HCl为共价化合物,故由原子构成,无氢离子,故B错误;
C、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和水的反应为歧化反应,故0.1mol过氧化钠和水反应转移0.1NA个电子,故C错误;
D、标况下2.24L二氧化碳和二氧化硫混合气体的物质的量为0.1mol,而二氧化碳和二氧化硫均为三原子分子,故0.1mol混合物中含0.3NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
取一定质量的某物质在ag氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后容器内有bg氧气,测得b>A.下列物质中满足上述结果的是
A.HCOOH B.HCHO C.CH4 D.C6H12O6
5.配制NaOH溶液时,下列操作情况会使结果偏高的是( )
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 使用容量瓶之前发现其内有少量蒸馏水残留 | |
| C. | 定容时,俯视容量瓶刻度线观察液面 | |
| D. | 定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
20.下列离子方程式中正确的是( )
| A. | 碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 过量的氯化铁和锌反应,锌溶解:2Fe3++Zn═2Fe2++Zn2+ | |
| C. | 醋酸和苯酚钠溶液的反应: O-+CH3COOH→ O-+CH3COOH→ OH↓+CH3COO- OH↓+CH3COO- | |
| D. | 碳酸氢钠溶液与氯化铝溶液反应:Al3++3HCO3-═Al(HCO3)3↓ |
6.表为元素周期表的局部,A、B、C、D为周期表中短周期元素,已知A原子最外电子层上的电子数是其次外层的一半.据此判断下列正确的是( )
| B | D | ||
| A | C |
| A. | A位于第2周期1A族 | B. | B的最高价氧化物的水化物是弱酸 | ||
| C. | 原子半径A>C>B>D | D. | 气态氢化物的热稳定性B>D>C>A |
16.下列除去杂质的方法正确的是( )
| A. | 除去N2中的少量O2:通过灼热的CuO粉末 | |
| B. | 除去CO2中的少量HCl:通入Na2CO3溶液 | |
| C. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| D. | 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个O原子 | |
| C. | 常温常压下,8g CH4的体积为11.2L | |
| D. | 标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA |
1.已知在一般的氧化还原反应中,氧化性关系为:氧化剂>氧化产物,还原性:还原剂>还原产物,R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z.这四种离子被还原成0价时表现的氧化性大小符合( )
| A. | R2+>X2+>Z2+>Y2+ | B. | X2+>R2+>Y2+>Z2+ | C. | Y2+>Z2+>R2+>X2+ | D. | Z2+>X2+>R2+>Y2+ |

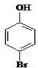 .
. 是化合物 B 的一种同分异构体,用1H 核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物 B 的一种同分异构体,用1H 核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. .
. .
. .
.