题目内容
实验室使用的浓盐酸的质量分数为36.5%,密度为 1.20g?cm-3.该浓盐酸的物质的量浓度为________,取该盐酸250mL与足量的Zn反应可以产生的H2在标准状况下的体积是________ L.
12.0mol/L 33.6
分析:根据c=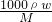 计算溶液的物质的量浓度,根据浓度和体积计算盐酸的物质的量,根据盐酸与锌反应的化学方程式计算生成氢气的物质的量,进而计算体积.
计算溶液的物质的量浓度,根据浓度和体积计算盐酸的物质的量,根据盐酸与锌反应的化学方程式计算生成氢气的物质的量,进而计算体积.
解答:质量分数为36.5%,密度为 1.20g?cm-3的浓盐酸的物质的量浓度为c=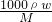 =
= =12.0mol/L,
=12.0mol/L,
250ml该盐酸的物质的量为:12.0mol/L×0.25L=3mol,
反应的方程式为:2HCl+Zn═ZnCl2+H2↑
则生成氢气的物质的量为n(H2)= n(HCl)=1.5mol,
n(HCl)=1.5mol,
产生的H2在标准状况下的体积为:1.5mol×22.4L/mol=33.6L,
故答案为:12.0mol/L;33.6L.
点评:本题考查物质的量的相关计算,题目难度不大,本题注意把握物质的量与体积、浓度的计算公式的运用.
分析:根据c=
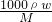 计算溶液的物质的量浓度,根据浓度和体积计算盐酸的物质的量,根据盐酸与锌反应的化学方程式计算生成氢气的物质的量,进而计算体积.
计算溶液的物质的量浓度,根据浓度和体积计算盐酸的物质的量,根据盐酸与锌反应的化学方程式计算生成氢气的物质的量,进而计算体积.解答:质量分数为36.5%,密度为 1.20g?cm-3的浓盐酸的物质的量浓度为c=
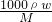 =
= =12.0mol/L,
=12.0mol/L,250ml该盐酸的物质的量为:12.0mol/L×0.25L=3mol,
反应的方程式为:2HCl+Zn═ZnCl2+H2↑
则生成氢气的物质的量为n(H2)=
 n(HCl)=1.5mol,
n(HCl)=1.5mol,产生的H2在标准状况下的体积为:1.5mol×22.4L/mol=33.6L,
故答案为:12.0mol/L;33.6L.
点评:本题考查物质的量的相关计算,题目难度不大,本题注意把握物质的量与体积、浓度的计算公式的运用.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目