题目内容
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是

A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中n(FeBr2)=6mol
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+): n(I-): n(Br-)=2:1:3
B
【解析】
试题分析:向含有Fe2+、I-、Br-的溶液中通入适量氯气,根据离子的还原性的强弱,氯气先与I-反应,后是Fe2+、Br-依次反应。A、AB段代表I-逐渐减少至0,消耗氯气的物质的量是1mol,说明I-的物质的量是2mol,BC段表示铁离子的物质的量逐渐增加,消耗氯气的物质的量是2mol,说明亚铁离子的物质的量是4mol,正确;B、根据A可知FeI2的物质的量是1mol和Fe元素守恒,则FeBr2的物质的量是3mol,错误;C、当通入Cl2 2mol时,1mol氯气与I-完全反应,剩余1mol氯气与2mol亚铁离子反应生成铁离子和氯离子,所以Fe2+、I-、氯气的物质的量之比是1:1:1,正确;D、FeBr2的物质的量是3mol,原溶液中Br-的物质的量是6mol,所以原溶液中n(Fe2+): n(I-): n(Br-)=4:2:6=2:1:3,正确,答案选B。
考点:考查对图像的分析、计算,氧化还原反应规律的应用

(12分)已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI ,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI ,反应到某时刻测得各组分的浓度如下:
物质 | HI | H2 | I2 |
浓度/(mol·L-1) | 0.40 | 0.60 | 0.60 |
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量 mol。
(2)达到平衡后HI的物质的量浓度 mol·L-1(请保留三位有效数字)。
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1∶4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为 。
(18分)1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):
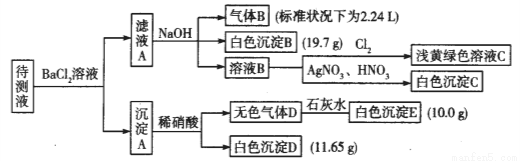
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/ mol·L-1 |
|
|
|
|
|
|
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:
________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能还原稀硝酸的成分是______________________________(写化学式)。
 CO(g) ΔH=-110.5 kJ·mol-1②Mg(g)+O2(g)
CO(g) ΔH=-110.5 kJ·mol-1②Mg(g)+O2(g) Mg(g)+CO(g),该反应的ΔH= 。
Mg(g)+CO(g),该反应的ΔH= 。



 KCl+3H2O+3Cl2↑,关于该反应的说法正确的是
KCl+3H2O+3Cl2↑,关于该反应的说法正确的是