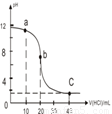
题目内容
室温下,用0.10mol/L的盐酸滴定20.00mL 0.10mol/L的某碱BOH溶液得到的滴定曲线如下,下列判断不正确的是

- A.a点时,溶液呈碱性,溶液中c(B+)>c(Cl-)
- B.b点时溶液的pH=7
- C.当c(Cl-)=c(B+)时,V(HCl)<20mL
- D.C点时溶液中c(H+)约为0.03mol/L
B
试题分析:从图像起点可以看出该碱为弱碱,A、a点为BOH—BCl共存的溶液,呈碱性,故有c(B+)>c(Cl-),正确;B、b点为滴定终点,生成强酸弱碱盐,水解呈酸性,故pH<7,错误;C、pH=7点,加入在b点之前,故V<20mL,正确;D、加入盐酸为40ml时,c(H+)=(0.1×40-0.1×20)÷60≈0.03mol/L,正确。
考点:考查电解质溶液,涉及弱电解的电离、盐类的水解等相关知识。
试题分析:从图像起点可以看出该碱为弱碱,A、a点为BOH—BCl共存的溶液,呈碱性,故有c(B+)>c(Cl-),正确;B、b点为滴定终点,生成强酸弱碱盐,水解呈酸性,故pH<7,错误;C、pH=7点,加入在b点之前,故V<20mL,正确;D、加入盐酸为40ml时,c(H+)=(0.1×40-0.1×20)÷60≈0.03mol/L,正确。
考点:考查电解质溶液,涉及弱电解的电离、盐类的水解等相关知识。

练习册系列答案
相关题目

 CH3COOH+OH-
CH3COOH+OH- 室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:
室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题: (2011?崇川区三模)在室温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前两种溶液的体积之和).下列说法正确的是( )
(2011?崇川区三模)在室温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前两种溶液的体积之和).下列说法正确的是( )