题目内容
(2013?临沭县模拟)为研究CH3COOH、HA和MOH的酸碱性的相对强弱,某兴趣小组设计了以下实验:室温下,将pH=2的两种酸溶液CH3COOH、HA和pH=12的碱MOH溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图1所示,根据所给数据,请回答下列问题:

(1)HA为
若b+c=14,则MOH为
(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/(H+)
(3)常温下,用0.10mol?L-1 NaOH溶液分别滴定20mL 0.10mol?L-1 HCl溶液和20mL 0.10 mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为

(1)HA为
强
强
酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的c(H+)大于
大于
醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).若b+c=14,则MOH为
弱
弱
碱(填“强”或“弱”).(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是
BD
BD
.A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/(H+)
(3)常温下,用0.10mol?L-1 NaOH溶液分别滴定20mL 0.10mol?L-1 HCl溶液和20mL 0.10 mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是
图3
图3
(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示)CH3COO-+H2O  CH3COOH+OH-
CH3COOH+OH-
 CH3COOH+OH-
CH3COOH+OH-CH3COO-+H2O  CH3COOH+OH-
CH3COOH+OH-
. CH3COOH+OH-
CH3COOH+OH-(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.分析:(1)pH=a的强酸,稀释10n倍后,溶液的pH=a+n,pH=a的弱酸,稀释10n倍后,溶液的pH介于a和a+n之间;稀释后 HA溶液PH大于醋酸溶液的PH,即HA溶液中c(H+)小于醋酸溶液中c(H+),溶液中c(H+)越小,对水的电离的抑制就越小,水电离的c(H+)越大,所以稀释后 HA溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来c(H+);b+c=14则酸溶液中的c(H+)与碱中的c(OH-)相等,说明二者电离程度相同,故碱为弱碱;
(2)溶液中存在以下平衡CH3COOH?CH3COO-+H+,加水平衡正移,c(H+) 减小,c(OH-)增大,Kw不变;
(3)醋酸是弱酸,存在电离平衡,溶液PH变化慢;当CH3COOH与NaOH恰好反应时生成的CH3COONa水解,溶液呈碱性;
(4)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离为主.
(2)溶液中存在以下平衡CH3COOH?CH3COO-+H+,加水平衡正移,c(H+) 减小,c(OH-)增大,Kw不变;
(3)醋酸是弱酸,存在电离平衡,溶液PH变化慢;当CH3COOH与NaOH恰好反应时生成的CH3COONa水解,溶液呈碱性;
(4)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离为主.
解答:解:(1)pH=a的强酸,稀释10n倍后,溶液的pH=a+n,pH=a的弱酸,稀释10n倍后,溶液的pH介于a和a+n之间,据此可确定HA为强酸;稀释后 HA溶液PH大于醋酸溶液的PH,即HA溶液中c(H+)小于醋酸溶液中c(H+),溶液中c(H+)越小,对水的电离的抑制就越小,水电离的c(H+)越大;b+c=14则酸溶液中的c(H+)与碱中的c(OH-)相等,说明二者电离程度相同,故碱为弱碱,
故答案为:强;大于;弱;
(2)溶液中存在以下平衡CH3COOH?CH3COO-+H+,加水平衡正移,
A、加水稀释PH增大,c(H+) 减小,故A错误;
B、
=
,平衡正移n(H+)增大,n(CH3COOH)减小,故比值增大,故B正确;
C、c(H+)?c(OH-) 只与温度有关,加水不变,故C错误;
D、加水稀释PH增大,c(H+) 减小,c(OH-)增大,故二者比值增大,故D正确;
故答案为:BD;
(3)醋酸是弱酸,存在电离平衡,溶液PH变化慢,所以PH变化慢的是醋酸,即图3是醋酸的;当CH3COOH与NaOH恰好反应时生成的CH3COONa水解,溶液呈碱性,所以PH大于7水解方程为:CH3COO-+H2O?CH3COOH+OH-,故答案为:图3;CH3COO-+H2O?CH3COOH+OH-;
(4)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离程度大于CH3COONa的水解程度所以c(CH3COO-)>c(Na+),溶液显酸性,c(H+)>c(OH-),因此c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
故答案为:强;大于;弱;
(2)溶液中存在以下平衡CH3COOH?CH3COO-+H+,加水平衡正移,
A、加水稀释PH增大,c(H+) 减小,故A错误;
B、
| c(H+) |
| c(CH3COOH) |
| n(H+) |
| n(CH3COOH) |
C、c(H+)?c(OH-) 只与温度有关,加水不变,故C错误;
D、加水稀释PH增大,c(H+) 减小,c(OH-)增大,故二者比值增大,故D正确;
故答案为:BD;
(3)醋酸是弱酸,存在电离平衡,溶液PH变化慢,所以PH变化慢的是醋酸,即图3是醋酸的;当CH3COOH与NaOH恰好反应时生成的CH3COONa水解,溶液呈碱性,所以PH大于7水解方程为:CH3COO-+H2O?CH3COOH+OH-,故答案为:图3;CH3COO-+H2O?CH3COOH+OH-;
(4)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离程度大于CH3COONa的水解程度所以c(CH3COO-)>c(Na+),溶液显酸性,c(H+)>c(OH-),因此c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评:本题考查了弱电解质的电离和盐类的水解,及离子浓度大小比较,题目难度一般.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
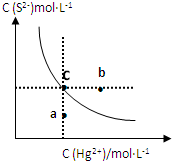 (2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 (R、R′可以是烃基或H原子)
(R、R′可以是烃基或H原子)

