题目内容
一定量的Mg和MgO的混合物投入100ml 2mol/L的稀盐酸中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是( )
| A、100ml |
| B、25ml |
| C、50ml |
| D、由于Mg、MgO的质量未知无法判断 |
考点:有关混合物反应的计算
专题:守恒法
分析:加入稀盐酸可能过量,则加入的氢氧化钠溶液,首先中和剩余的盐酸,然后沉淀镁离子,当加入的氢氧化钠使镁离子恰好沉淀,所需的氢氧化钠溶液体积最小,此时最后溶液为氯化钠溶液,根据氯离子、钠离子守恒计算所需氢氧化钠的物质的量,根据n=cV计算氢氧化钠溶液的体积.
解答:
解:加入的氢氧化钠溶液,首先中和剩余的盐酸(盐酸也可能没剩余),然后沉淀镁离子,当加入的氢氧化钠使镁离子恰好沉淀,所需的氢氧化钠溶液体积最小,此时最后溶液为氯化钠溶液,
根据氯离子守恒可得:n(NaCl)=n(HCl)=0.1L×2mol/L=0.2mol,
根据钠离子守恒可得:n(NaOH)=n(NaCl)=0.2mol,
所以需4mol/L的NaOH溶液的最小体积为:
=0.05L=50mL,
故选C.
根据氯离子守恒可得:n(NaCl)=n(HCl)=0.1L×2mol/L=0.2mol,
根据钠离子守恒可得:n(NaOH)=n(NaCl)=0.2mol,
所以需4mol/L的NaOH溶液的最小体积为:
| 0.2mol |
| 4mol/L |
故选C.
点评:本题考查物质的量浓度的有关计算、混合物反应的计算,题目难度中等,明确加入氢氧化钠溶液体积最小且镁离子完全沉淀,此时的溶质为氯化钠为解答关键,注意质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
下列过程中的焓变小于零的是( )
| A、石灰石高温分解 |
| B、氢氧化钡晶体与氯化铵晶体反应 |
| C、二氧化碳与碳反应 |
| D、铝与盐酸反应 |
下列萃取与分液相结合进行的操作(用苯从碘水中萃取碘单质,且已知苯的密度比水小)中错误的是( )
| A、碘水和苯加入分液漏斗后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡,并不时地放气 |
| B、静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出,及时关闭活塞 |
| D、最后继续打开活塞,另用烧杯在分液漏斗的下口承接并保存上层液体 |
两种金属粉末混合物14克,投入足量的稀硫酸中,产生1克氢气,则金属的混合物不可能是( )
①Fe ②Zn ③Al ④Mg.
①Fe ②Zn ③Al ④Mg.
| A、①② | B、②③ | C、①③ | D、①④ |
分别燃烧下列各组物质中的两种有机化合物,所得CO2和H2O的物质的量之比相同的有( )
| A、乙烯、丁二烯 |
| B、乙醇、乙醚 |
| C、苯、苯酚 |
| D、醋酸、葡萄糖 |
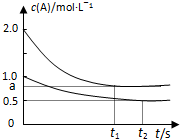 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( ) | 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)<v(逆) |
在pH都等于9的KOH和CH3COOK两种溶液中,设由水电离产生的OH-离子浓度分别为Xmol/L与Ymol/L,则X和Y的关系为( )
| A、X=Y |
| B、Y=10-4 X |
| C、X=10-4 Y |
| D、X>Y |
下列哪一项是通过降低反应所需的能量和增加活化分子的百分数来加快反应速率的( )
| A、增大物质的量浓度 |
| B、增大压强 |
| C、升高温度 |
| D、使用催化剂 |