题目内容
9. 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )| A. | 原子半径:B>C>A | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 含B元素的盐溶液一定显酸性 | |
| D. | 最简单气态氢化物的热稳定性:A>C |
分析 短周期元素A、B、C、D所处的位置,可确定B、C、D为第三周期的元素,A为第二周期元素,B所处的周期序数与族序数相等,则B为Al元素,故C为Si元素,D为S元素,A为N元素,结合元素周期律解答.
解答 解:短周期元素A、B、C、D所处的位置,可确定B、C、D为第三周期的元素,A为第二周期元素,B所处的周期序数与族序数相等,则B为Al元素,故C为Si元素,D为S元素,A为N元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:B>C>A,故A正确;
B.非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C.B为铝元素,若为偏铝酸盐,盐溶液可能为碱性,若为铝盐,其溶液可能为酸性,故C错误;
D.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,难度中等,侧重于学生的分析能力的考查,注意对元素周期律理解掌握.

练习册系列答案
相关题目
20.从柑橘中可提炼得到结构为 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )
 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 难溶于水,且密度比水大 |
17.下列离子方程式正确的是( )
| A. | 氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 5.6g Fe与200mL2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
14.厨房中常用到食盐、食醋、纯碱、小苏打、淀粉等物质,利用这些物质你不能完成的实验是( )
| A. | 检验鸡蛋壳能否溶解在酸中 | B. | 检验食盐中是否加碘 | ||
| C. | 除去热水瓶内壁上的水垢 | D. | 鉴别食盐和纯碱 |
18.A、B、C、D、E是原子序数依次增大的短周期元素,A可以与氢组成气态氢化物分子中氢元素的质量百分含量为最高的物质,C是地壳中含量最高的金属,D与C可以形成C2D3型的化合物.
(1)C的离子结构示意图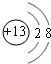 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为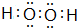
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
(4)C2D3能否通过复分解反应制取不能原因Al3+、S2-在水溶液中发生强烈双水解生成Al(OH)3与H2S
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
(1)C的离子结构示意图
 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为
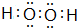
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子. .
.