题目内容
10分)使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸。
Ⅰ.实验步骤:
(1)滴定前的准备
①滴定管:___________________→洗涤→润洗→装液→赶气泡→调液面→记录。记录盛装 0.1000 mol/L NaOH溶液的碱式滴定管的初始读数时,液面位置如图所示,则此时的读数为_____________mL。
②锥形瓶:用酸式滴定管量取待测稀盐酸20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂。
(2)滴定
用标准的NaOH溶液滴定待测的稀盐酸时,左手操作滴定管活塞,右手旋摇锥形瓶,眼睛注视 。滴定至终点时,记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
 滴定次数 滴定次数实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
(1)结合上表数据,计算被测稀盐酸的物质的量浓度是____________mol/L.
(2)在本实验中,下列操作(其他操作正确)会造成测定结果偏低的有______.
A.锥形瓶水洗后未干燥
B.碱式滴定管未用标准NaOH溶液润洗
C.滴定终点读数时俯视读数
D.配制标准液的NaOH固体中混有少量KOH固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.(1)①检查是否漏水②0.70mL(2)锥形瓶中溶液的颜色变化 Ⅲ. (1)0.075(2)C
解析试题分析:Ⅰ.(1)①锥形瓶在使用前一定要检查是否漏水②滴定管精确到0.1 mL,还要估读,读数就保留到小数点2位,液面与7格处相切,每格是0.1 mL,所以是0.70 mL。(2)滴定过程中眼睛要注视溶液的颜色变化。Ⅲ.(1)四组数据中第一组数据相差太大舍去不要,取后三组数据的平均值为15.00 mL,c(HCl)×V(HCl)=c(NaOH )×V( NaOH),得c(HCl)×20.00=0.100×15.00,c(HCl)="0.075" mol/L. (2)“锥形瓶水洗后未干燥”对实验结果没有影响;A错;“碱式滴定管未用标准NaOH溶液润洗”会造成NaOH的浓度变小,用量增多,测定结果偏高;B错;“滴定终点读数时俯视读数”造成NaOH的体积变小,盐酸的浓度偏低,C对;“配制标准液的NaOH固体中混有少量KOH固体”会造成NaOH的物质的量减少,用量增大,使得盐酸的浓度偏高,D错;“碱式滴定管尖嘴部分有气泡,滴定后消失” NaOH的用量增多,盐酸的浓度偏大。
考点:酸碱中和滴定。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案下列物质含有离子键的是
| A.Br2 | B.CO2 | C.NaBr | D.H2O |
在相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.电离度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL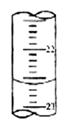
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验 编号 | NaOH溶液的浓度 (mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 25.80 | 20.00 |
| 3 | 0.10 | 22.62 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
| A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm |
| B.调节滴定管液面至0或0刻度以下,记下读数 |
| C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度 |
| D.用标准液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次 |
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理 。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母表示) 。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,滴定终点的现象是_________________________________。
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH) /mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH) /mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
下列物质中,其产量可以用来衡量一个国家石油化工发展水平的是
| A.甲烷 | B.乙烯 | C.汽油 | D.乙醇 |
下列关于油脂的叙述中不正确的是
| A.油脂属于酯类 | B.油脂没有固定的熔沸点 |
| C.油脂是高级脂肪酸的甘油酯 | D.油脂属于高分子化合物 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是 
| A.蒸馏、蒸发、分液、升华 | B.蒸馏、洗气、分液、蒸发 |
| C.蒸馏、分液、过滤、升华 | D.蒸发、分液、过滤、蒸馏 |