题目内容
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
(1)X的原子结构示意图是 ;含1mol X的氧化物晶体中含有共价键数目为 .(阿伏加德罗常数可以用NA表示)
(2)Z与钙离子组成的化合物的电子式为 .
(3)14g Y完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式: .
(4)组成W的元素最高价氧化物对应水化物甲有如图所示转化关系,丁为常见的金属单质.(反应条件和其它物质已略)
甲
乙
丙
写出反应①的离子反应方程式: ;
写出反应②的离子反应方程式: ;
写出丁在高温水蒸气中发生的化学反应方程式: ;
(5)W元素的简单氢化物极易溶于水,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其正极的电极反应方程式为 .
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两负电荷 | 0 |
(2)Z与钙离子组成的化合物的电子式为
(3)14g Y完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式:
(4)组成W的元素最高价氧化物对应水化物甲有如图所示转化关系,丁为常见的金属单质.(反应条件和其它物质已略)
甲
| 丁 |
| 反应① |
| 丁 |
| 反应② |
写出反应①的离子反应方程式:
写出反应②的离子反应方程式:
写出丁在高温水蒸气中发生的化学反应方程式:
(5)W元素的简单氢化物极易溶于水,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其正极的电极反应方程式为
考点:无机物的推断
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种含14个电子的粒子,X为单核,电荷数为0,故X的质子数为14,X为Si原子;Y为不同元素构成的两核粒子,粒子电荷数为0,故Y为CO;Z为同元素构成的两核粒子,粒子电荷数为-2,故形成Z元素的原子质子数为
=6,故Z为C22-;W为同元素构成的两核粒子,粒子电荷数为0,故形成W元素的原子质子数为
=7,为N元素,W为N2,
(1)X为Si元素,其原子核外有3个电子层、最外层电子数是4,据此书写其原子结构示意图;二氧化硅晶体中每个Si原子和4个O原子形成4个Si-O键;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,碳化钙电子式为: ,
,
(3)14gCO的物质的量n=
=
=0.5mol,计算2molCO燃烧放出的热量,结合热化学方程式书写原则书写;
(4)组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;
稀硝酸和少量Fe反应生成硝酸铁、NO和水;硝酸铁和Fe反应生成硝酸亚铁;高温下,铁和水蒸气反应生成四氧化三铁和氢气;
(5)该燃料电池中,正极上氧气得电子和水反应生成氢氧根离子.
| 14-2 |
| 2 |
| 14 |
| 2 |
(1)X为Si元素,其原子核外有3个电子层、最外层电子数是4,据此书写其原子结构示意图;二氧化硅晶体中每个Si原子和4个O原子形成4个Si-O键;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,碳化钙电子式为:
 ,
,(3)14gCO的物质的量n=
| m |
| M |
| 14g |
| 28g/mol |
(4)组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;
稀硝酸和少量Fe反应生成硝酸铁、NO和水;硝酸铁和Fe反应生成硝酸亚铁;高温下,铁和水蒸气反应生成四氧化三铁和氢气;
(5)该燃料电池中,正极上氧气得电子和水反应生成氢氧根离子.
解答:
解:X、Y、Z、W四种含14个电子的粒子,X为单核,电荷数为0,故X的质子数为14,X为Si原子;Y为不同元素构成的两核粒子,粒子电荷数为0,故Y为CO;Z为同元素构成的两核粒子,粒子电荷数为-2,故形成Z元素的原子质子数为
=6,故Z为C22-;W为同元素构成的两核粒子,粒子电荷数为0,故形成W元素的原子质子数为
=7,为N元素,W为N2,
(1)X为Si元素,其原子核外有3个电子层、最外层电子数是4,其原子结构示意图为 ;SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键,
;SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键,
故答案为: ;4NA;
;4NA;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,其电子式为 ,故答案为:
,故答案为: ;
;
(3)14gCO的物质的量n=
=
=0.5mol,0.5molCO完全燃烧放出141.5kJ热量,则2molCO完全燃烧放出566kJ热量,则CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
(4)组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;
稀硝酸和少量Fe反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O;
硝酸铁和Fe反应生成硝酸亚铁,离子方程式为2Fe3++Fe=3Fe2+;
高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)
Fe3O4+4H2;
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;2Fe3++Fe=3Fe2+;3Fe+4H2O(g)
Fe3O4+4H2;
(5)该燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-.
| 14-2 |
| 2 |
| 14 |
| 2 |
(1)X为Si元素,其原子核外有3个电子层、最外层电子数是4,其原子结构示意图为
 ;SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键,
;SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键,故答案为:
 ;4NA;
;4NA;(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,其电子式为
 ,故答案为:
,故答案为: ;
;(3)14gCO的物质的量n=
| m |
| M |
| 14g |
| 28g/mol |
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
(4)组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;
稀硝酸和少量Fe反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O;
硝酸铁和Fe反应生成硝酸亚铁,离子方程式为2Fe3++Fe=3Fe2+;
高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)
| ||
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;2Fe3++Fe=3Fe2+;3Fe+4H2O(g)
| ||
(5)该燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-.
点评:本题考查了物质推断,涉及原电池原理、热化学反应、物质结构等知识点,综合性较强,同时考查学生对知识点的掌握及应用能力,难点是电极反应式的书写,注意二氧化硅晶体结构,题目难度中等.

练习册系列答案
相关题目
常温下,已知0.1mol?L-1的CH3COOH和HCN溶液的PH分别为a、b,且1<a<b.下列有关叙述不正确的是( )


| A、常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 |
| B、在NaCN溶液中:c (Na+)+c (H+)═c (OH-)+c (CN-) |
| C、相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 |
| D、常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示 |
N-H键键能为391.5kJ/mol,其含义是( )
| A、由N和H形成1 mol NH3所放出的能量 |
| B、把1 mol NH3中的共价键全部拆开所吸收的能量 |
| C、拆开NA个N-H键所吸收的能量 |
| D、形成1个 N-H键所放出的能量 |
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.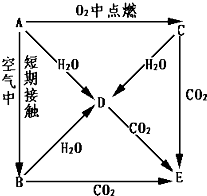 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.