题目内容
除去下列物质中少量杂质的方法不正确的是( )
| A、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| B、除去CO2中混有的HCl:用饱和NaHCO3溶液洗气 |
| C、除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤 |
| D、除去乙炔中混有的少量H2S、PH3:通过CuSO4溶液后,洗气 |
考点:物质的分离、提纯和除杂
专题:化学实验基本操作
分析:A.Fe与氯化铁反应生成氯化亚铁;
B.盐酸与碳酸氢钠反应生成二氧化碳;
C.碳酸钡与盐酸反应;
D.硫化氢与硫酸铜反应生成硫化铜沉淀.
B.盐酸与碳酸氢钠反应生成二氧化碳;
C.碳酸钡与盐酸反应;
D.硫化氢与硫酸铜反应生成硫化铜沉淀.
解答:
解:A.Fe与氯化铁反应生成氯化亚铁,则加入过量铁粉,过滤可除杂,故A正确;
B.盐酸与碳酸氢钠反应生成二氧化碳,除去混有的HCl,故B正确;
C.碳酸钡与盐酸反应,将原物质反应掉,不符合除杂原则,故C错误;
D.硫化氢与硫酸铜反应生成硫化铜沉淀,可除杂,故D正确.
故选C.
B.盐酸与碳酸氢钠反应生成二氧化碳,除去混有的HCl,故B正确;
C.碳酸钡与盐酸反应,将原物质反应掉,不符合除杂原则,故C错误;
D.硫化氢与硫酸铜反应生成硫化铜沉淀,可除杂,故D正确.
故选C.
点评:本题综合考查物质的分离、提纯,为考查常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质,且不能影响被提纯物质的性质,难度不大.

练习册系列答案
相关题目
下列关于平衡常数的说法正确的是( )
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、化学平衡移动时,平衡常数一定改变 |
| C、化学平衡常数大的可逆反应,所有反应物的转化率一定大 |
| D、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
实验室里需用420mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,操作正确的是( )
| A、用天平称取6.72g硫酸铜,加入500mL水 |
| B、用天平称取7.0g硫酸铜,加入500mL水 |
| C、用天平称取12.5g胆矾,配成500mL溶液 |
| D、用天平称取10.5g胆矾,配成500mL溶液 |
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论错误的是( )


| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| D、保持其他条件不变,升高温度,化学平衡向逆反应方向移动 |
有关3BrF3+5H2O═HBrO3+Br2+9HF+O2↑反应的叙述中,正确的是( )
| A、还原剂和氧化剂的物质的量之比为5:3 |
| B、HBrO3和HF是还原产物 |
| C、生成1molO2,转移4mol电子 |
| D、BrF3既是氧化剂,又是还原剂 |
下列各项叙述中不正确的是( )
| A、10℃时NaCl溶解度为35.7g,则此时饱和NaCl 溶液的质量分数小于35.7% |
| B、向Na2CO3溶液中加入少量NaHCO3 固体,溶液pH 减小 |
| C、50mL1.0mol?L-1盐酸与60mL 1.0 mol?L-1盐酸分别跟50mL 1.1mol?L-1NaOH溶液进行反应,中和热数值不相等 |
| D、一定条件下,向水中加入少量NaHSO4,可使水的电离程度减小 |
下列变化或数据与氢键无关的是( )
| A、水的沸点比硫化氢的沸点高 |
| B、氨分子易溶于水 |
| C、冰可以浮在水面上 |
| D、H2O是一种非常稳定的化合物 |
下列有关试剂的保存方法,错误的是( )
| A、新制氯水保存在无色玻璃试剂瓶中 |
| B、氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 |
| C、少量的钠保存在煤油中 |
| D、二氧化硅常用于制造光导纤维 |
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式为C2H4 |
| B、质子数为53,中子数为78的碘原子:53131I |
C、S2-的结构示意图: |
D、NH4Cl的电子式为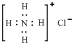 |