题目内容
下列实验现象正确且所推出的结论也正确的是( )
| A、向溶液中滴加盐酸产生的气体能使澄清石灰水变浑浊,说明该溶液中一定有CO32- |
| B、向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液均有固体析出,说明蛋白质遇到盐溶液都会盐析 |
| C、溴水中加入足量Na2SO3溶液可以使溴水褪色,说明Na2SO3有还原性 |
| D、Cl2、SO2均能使紫色石蕊溶液褪色,说明二者均有漂白性 |
考点:常见阴离子的检验,氯气的化学性质,二氧化硫的化学性质,含硫物质的性质及综合应用,氨基酸、蛋白质的结构和性质特点
专题:元素及其化合物
分析:A.产生的气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子,不一定含有碳酸根离子;
B.铜离子为重金属离子,硫酸铜溶液使蛋白质变性,不是盐析;
C.溴水具有氧化性,能够将亚硫酸钠氧化成硫酸钠;
D.氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性.
B.铜离子为重金属离子,硫酸铜溶液使蛋白质变性,不是盐析;
C.溴水具有氧化性,能够将亚硫酸钠氧化成硫酸钠;
D.氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性.
解答:
解:A.向溶液中滴加盐酸产生的气体能使澄清石灰水变浑浊,该气体可能为二氧化碳或二氧化硫,原溶液中可能含有HCO3-、SO32-,该溶液中不一定有CO32-,
故A错误;
B.氯化钠溶液使蛋白质发生盐析,而硫酸铜溶液使蛋白质发生了变性,故B错误;
C.溴水中加入足量Na2SO3溶液可以使溴水褪色,溴水将亚硫酸钠氧化成硫酸钠,说明Na2SO3有还原性,故C正确;
D.Cl2、SO2均能使紫色石蕊溶液褪色,说明二氧化硫、氯水具有漂白性,因为干燥的氯气不具有漂白性,具有漂白性的是次氯酸,故D错误;
故选C.
故A错误;
B.氯化钠溶液使蛋白质发生盐析,而硫酸铜溶液使蛋白质发生了变性,故B错误;
C.溴水中加入足量Na2SO3溶液可以使溴水褪色,溴水将亚硫酸钠氧化成硫酸钠,说明Na2SO3有还原性,故C正确;
D.Cl2、SO2均能使紫色石蕊溶液褪色,说明二氧化硫、氯水具有漂白性,因为干燥的氯气不具有漂白性,具有漂白性的是次氯酸,故D错误;
故选C.
点评:本题考查了常见阴离子的检验、氯气与二氧化硫的化学性质及漂白性、蛋白质的变性与盐析等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列说法中正确的是( )
| A、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| B、测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 |
| C、实验中为了得到纯净的晶体,制得的硫酸亚铁铵和阿司匹林晶体均用酒精洗涤 |
| D、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净 |
某氯化钠溶液中含有少量氯化铁,现欲除去杂质氯化铁,并得到氯化钠晶体,可供选择的操作有①结晶 ②加过量NaOH溶液 ③加适量盐酸 ④过滤 ⑤加热蒸发.正确的操作步骤是( )
| A、①③④⑥ | B、②④③⑤① |
| C、③④②⑤ | D、②④⑤① |
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
| A、正极附近的SO42-离子浓度逐渐增大 |
| B、正极有O2逸出 |
| C、电子通过导线由铜片流向锌片 |
| D、铜片上有H2逸出 |
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A、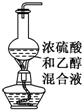 实验室制乙烯 |
B、 实验室制乙炔并验证其还原性 |
C、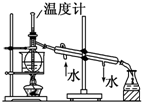 实验室中分馏石油 |
D、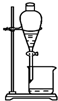 分离水和苯的混合物 |
如图四种化学实验操作,其中正确的是( )
A、 准备称量 |
B、 金属钠与空气加热 |
C、 分液 |
D、 配置一定物质的量浓度溶液 |
要除去氯化亚铁溶液中的少量氯化铁,可行的办法是( )
| A、滴入KSCN溶液 |
| B、通入氯气 |
| C、加入铜粉 |
| D、加入铁粉 |
下列对有关元素的叙述能说明该元素一定是主族元素的是( )
| A、原子核外M层有8个电子的元素 |
| B、原子核外L层比M层多一个电子的元素 |
| C、最高价为+7价的元素 |
| D、原子最外层电子数为2的元素 |