题目内容
下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 稳定性:盐酸>硅酸 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe3+,没有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫色 | 碘在CCl4中的溶解度较大 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.实验只能证明酸性强弱;
B.先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+;
C.铁与浓硫酸发生钝化反应;
D.四氯化碳密度比水大,碘易溶于四氯化碳.
B.先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+;
C.铁与浓硫酸发生钝化反应;
D.四氯化碳密度比水大,碘易溶于四氯化碳.
解答:
解:A.反应在溶液中进行,可证明酸性盐酸>硅酸,不能证明稳定性强弱,故A错误;
B.先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+,故B错误;
C.铁与浓硫酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,故C错误;
D.四氯化碳密度比水大,碘易溶于四氯化碳,可观察到液体分层,上层基本无色,下层紫色,故D正确.
故选D.
B.先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+,故B错误;
C.铁与浓硫酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,故C错误;
D.四氯化碳密度比水大,碘易溶于四氯化碳,可观察到液体分层,上层基本无色,下层紫色,故D正确.
故选D.
点评:本题考查化学实验方案的评价,涉及物质的性质比较、检验、分离等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、T℃时,1L pH=6的纯水中,含有的OH-数目为l×10-8NA |
| B、一定条件下,2.3g的Na完全与O2反应生成 3.6g产物时失去的电子数为0.1NA |
| C、1.0L的0.1 mol?L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D、标准状况下,22.4L的SO3中含有的SO3分子数为NA |
下列溶液中能大量共存的离子组是( )
| A、I-、Cl-、ClO-、Na+ |
| B、K+、Ba2+、OH-、NO3- |
| C、H+、Fe2+、NO3-、MnO4- |
| D、Al3+、NH4+、HCO3-、NO3- |
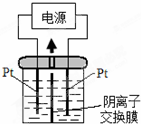 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |
下列反应H2O既不是氧化剂也不是还原剂的是( )
| A、Cl2+H2O?Cl-+H++HClO | ||||
| B、NaH+H2O═NaOH+H2↑ | ||||
| C、2Na+2H2O═2NaOH+H2↑ | ||||
D、2H2O
|
 (1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
(1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
