题目内容
 某小组为研究原电池工作原理设计了如图装置.下列叙述中,不正确的是( )
某小组为研究原电池工作原理设计了如图装置.下列叙述中,不正确的是( )分析:A、a和b不连接时,Fe与硫酸铜溶液发生置换反应;
B、a和b用导线连接时,形成原电池,Fe作负极,Cu作正极;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;
D、a和b用导线连接时,易失电子的金属作负极.
B、a和b用导线连接时,形成原电池,Fe作负极,Cu作正极;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;
D、a和b用导线连接时,易失电子的金属作负极.
解答:解:A、a和b不连接时,Fe与硫酸铜溶液发生置换反应,则在铁片上有金属铜析出,故A正确;
B、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,Cu作正极,发生还原反应,电极反应为Cu2++2e-=Cu,故B正确;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu,则溶液从蓝色逐渐变成浅绿色,故C正确;
D、a和b用导线连接时,易失电子的金属铁作负极,则铜作正极,故D错误;
故选D.
B、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,Cu作正极,发生还原反应,电极反应为Cu2++2e-=Cu,故B正确;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu,则溶液从蓝色逐渐变成浅绿色,故C正确;
D、a和b用导线连接时,易失电子的金属铁作负极,则铜作正极,故D错误;
故选D.
点评:本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
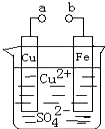 某小组为研究原电池工作原理,设计如图装置.下列叙述不正确的是( )
某小组为研究原电池工作原理,设计如图装置.下列叙述不正确的是( )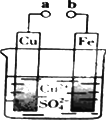

 某小组为研究原电池工作原理,设计如图装置.下列叙述不正确的是( )
某小组为研究原电池工作原理,设计如图装置.下列叙述不正确的是( )