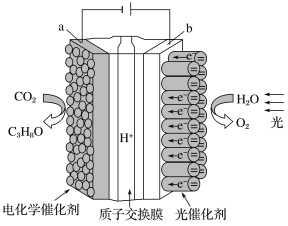
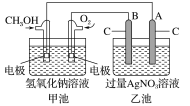
题目内容
【题目】一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiA12C17+3LiFePO4(s)![]() A1+3FePO4+7LiA1C14。下列说法正确的是
A1+3FePO4+7LiA1C14。下列说法正确的是
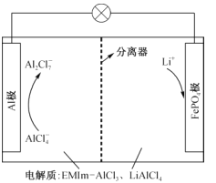
A.放电时,向正极迁移的是 Al3+
B.放电时,A1极上的电势比FePO4极上的高
C.充电时,阴极反应式:A12C17-+6e- = 2A1+7C1-
D.充电时,阳极反应式:LiFePO4—e- = FePO4+Li+
【答案】D
【解析】
由总反应式可以看出,放电时,Al失电子,则Al极作负极,发生反应Al-3e- +7A1C14- =4A12C17-;从而得出FePO4极为正极,电极反应3FePO4+3e-+3Li+=3LiFePO4(s)。
A.放电时,阳离子向正极迁移,但溶液中不含有Al3+,所以向正极迁移的是Li+而不是 Al3+,A不正确;
B.放电时,A1极为负极,其电势比FePO4极(正极)上的低, B不正确;
C.充电时,阴极反应式:4A12C17-+3e- =Al+7A1C14-,C不正确;
D.由电池反应式看,充电时,在阳极LiFePO4失电子转化为FePO4和Li+,所以电极反应式:LiFePO4-e- = FePO4+Li+,D正确;
故选D。

【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常条件下反应制得,反应方程式为![]() 。
。
已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能( | 243 | a | 607 | 630 |
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为___kJ。(用数字和字母表示)
(2)温度一定时,在一个体积为1L的密闭容器中通入2mol NO和1mol Cl2,10min时ClNO体积占气体总体积40%,反应开始到10min内NO的平均反应速率:![]() =___
=___![]() 。
。
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图所示:
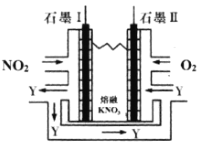
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源____极,石墨Ⅱ附近发生的电极反应式为___。
(4)含氮废水进入水体会造成富营养化,常使用次氯酸去除氨氮(以NH4+表示),生成无毒无害物质。次氯酸氧化除去氨氮的离子反应方程式是____。