题目内容
10.按要求填空:①碳酸氢钠固体 ②液态SO2 ③冰醋酸 ④汞 ⑤H2SO4 ⑥纯蔗糖(C12H22O11) ⑦氢氧化钡溶液 ⑧KNO3⑨熔融氢氧化钠 ⑩氢氧化铁胶体(1)下列物质能导电的强电解质是⑨,属于弱电解质的是③(均填序号).
(2)将物质①配制成溶液,取少量该溶液与足量⑦溶液中反应时,写出此时的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(3)将⑩装入U型管中,分别插入两个电极接通电源在U型管中看到的现象是阴极附近颜色加深,阳极附近颜色变浅;原因是氢氧化铁胶体的胶粒带正电,向阴极移动.
(4)向⑩胶体中逐滴加入盐酸溶液,会出现一系列变化.先出现红褐色沉淀,原因加入电解质后,使胶体聚沉;随后沉淀溶解,溶液呈黄色,此反应的离子方程式是Fe(OH)3+3H+=Fe3++3H2O.
分析 (1)强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
(2)设量少的NaHCO3的物质的量为1mol,根据其需要来确定要消耗的Ba2+和OH-的物质的量;
(3)氢氧化铁胶体的胶粒带正电,向阴极移动;
(4)盐酸是电解质溶液,能使胶体发生聚沉变为氢氧化铁沉淀;氢氧化铁沉淀能溶于盐酸生成氯化铁溶液.
解答 解:(1)①碳酸氢钠固体在水溶液中能完全电离,故为强电解质,但不能导电; ②液态SO2是非电解质; ③冰醋酸在水溶液中不能完全电离,故为弱电解质; ④汞是单质,既不是电解质也不是非电解质; ⑤H2SO4 在水溶液中能完全电离,故为强电解质,但不能导电; ⑥纯蔗糖(C12H22O11)是非电解质; ⑦氢氧化钡溶液是混合物,既不是电解质也不是非电解质; ⑧KNO3在水溶液中和熔融状态下均能完全电离,故为强电解质,但不能导电;⑨熔融氢氧化钠能完全电离,故为强电解质,且能导电; ⑩氢氧化铁胶体是混合物,既不是电解质也不是非电解质.
故能导电的强电解质是⑨,属于弱电解质的是③.
故答案为:⑨;③;
(2)设量少的NaHCO3的物质的量为1mol,含1molHCO3-,故能消耗1molBa2+和1molOH-,故离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(3)氢氧化铁胶体的胶粒带正电,向阴极移动,因此阴极附近颜色加深,阳极附近颜色变浅,
故答案为:阴极附近颜色加深,阳极附近颜色变浅;氢氧化铁胶体的胶粒带正电,向阴极移动;
(4)盐酸是电解质溶液,能使胶体发生聚沉变为氢氧化铁沉淀;氢氧化铁沉淀能溶于盐酸生成氯化铁溶液,离子方程式为Fe(OH)3+3H+=Fe3++3H2O,
故答案为:加入电解质后,使胶体聚沉; Fe(OH)3+3H+=Fe3++3H2O.
点评 本题重点考查了电解质、非电解质概念的辨析、强、弱电解质的判断,抓住电解质必须是化合物,抓住弱电解质的特征“部分电离”,强电解质”在水溶液中或熔融状态下,能完全电离”是解答本题的关键,题目难度不大.

| A. | 合金必须是由两种或两种以上的金属组成 | |
| B. | 水银是合金 | |
| C. | 形成合金后,其熔点一般会提高 | |
| D. | 形成合金后,其硬度一般会增大 |
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 碘易溶于酒精,所以用酒精从碘水中萃取碘 | |
| C. | 液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封? | |
| D. | 检验某溶液是否含有SO42- 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1molAlN需转移6mol电子 | |
| C. | AlN属于离子化合物,其中氮元素的化合价为+3 | |
| D. | AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑ |
| A. | 1mol羧酸B在光照条件下最多可与4mol氯气发生取代反应 | |
| B. | l酯A只能在碱性溶液中才能水解 | |
| C. | 1mol酯A最多可与2mol NaOH溶液发生反应 | |
| D. | 题中酸也能燃烧可知有机物均可在氧气中点燃 |
| A. | 不同原子构成的物质可能是单质、化合物或混合物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成 |
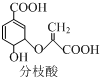
| A. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3molNaOH发生中和反应 |
| A. |  | B. |  | C. |  | D. |  |