题目内容
8.解释下列事实的离子方程式或电极反应式不正确的是( )| A. | 酸性KI淀粉溶液在空气中久置后变蓝:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 铅蓄电池充电时阴极质量减轻:PbSO4+2e-=Pb+SO42- | |
| D. | 明矾与足量Ba(OH)2溶液混合有沉淀出现:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
分析 A.酸性溶液中氢氧根离子不能大量存在;
B.碳酸钙比硫酸钙更难溶,硫酸钙沉淀转化成碳酸钙沉淀;
C.铅蓄电池的阴极发生还原反应,铅离子得到电子生成铅单质;
D.氢氧化钡足量,铝离子完全转化成偏铝酸根离子.
解答 解:A.酸性溶液中,反应产物不会存在氢氧根离子,正确的离子方程式为:4I-+O2+4H+=2I2+2H2O,故A错误;
B.用Na2CO3溶液处理水垢中的CaSO4,实现了沉淀的转化,反应的离子方程式为:CO32-+CaSO4?CaCO3+SO42-,故B正确;
C.铅蓄电池充电时阴极硫酸铅中铅离子得到电子生成铅单质,导致质量减轻,反应的离子方程式为:PbSO4+2e-=Pb+SO42-,故C正确;
D.明矾与足量Ba(OH)2溶液混合,铝离子与足量氢氧根离子反应生成偏铝酸根离子,同时生成硫酸钡沉淀,反应的离子方程式为::Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O,故D正确;
故选A.
点评 本题考查了离子方程式的书写,题目难度中等,明确离子方程式的书写原则及电解原理为解答关键,A为易错点,注意反应溶液的酸碱性,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
16.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
3. 咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
 咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )| A. | 该物质中苯环上一氯化物有2种 | |
| B. | 所有碳原子不可能都在同一平面上 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 1mol该物质可以与1.5mol碳酸钠溶液反应生成1.5molCO2 |
13.根据下列各图曲线表征的信息,得出的结论不正确的是( )
| A. | 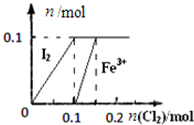 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 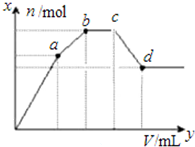 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
20.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+K+OH-Cl- | B. | Na+Cu2+SO42-NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
18. 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )| 制取气体 | 实验药品 | 收集气体方法 | |
| A | 二氧化碳 | 碳酸钙、稀硫酸 | 排饱和碳酸氢钠溶液 |
| B | 氧气 | 双氧水、二氧化锰 | 排水法 |
| C | 氨气 | 氧氡化钠溶液、浓氨水 | 向下排空气法 |
| D | 乙烯 | 氯乙烷,氢氧化钠、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |

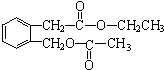 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$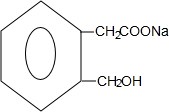 +CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);
+CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);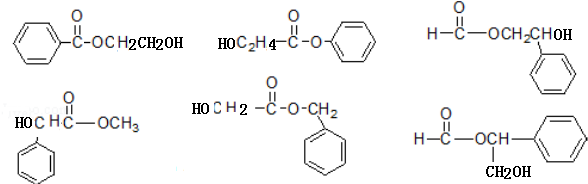 (任写两个).
(任写两个).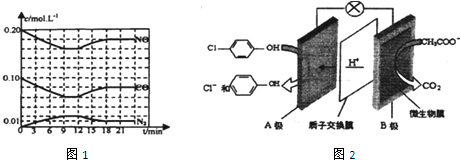
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示
 (不包括A)
(不包括A) ;反应类型是酯化反应(或取代反应).
;反应类型是酯化反应(或取代反应). .
.