题目内容
13.根据下列各图曲线表征的信息,得出的结论不正确的是( )| A. | 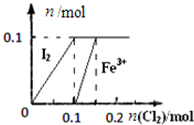 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. |  表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
分析 A.n(FeI2)=0.1L×1mol/L=0.1mol,n( I-)=0.2mol、n(Fe2+)=0.1mol,碘离子还原性大于亚铁离子,所以碘离子先被氯气氧化、后亚铁离子被氯气氧化,发生的离子反应方程式分别为2 I-+Cl2=I2+2Cl-、2Fe2++Cl2=2Cl-+2Fe3+,根据氯气和碘离子、亚铁离子之间的关系式计算;
B.加入Ba(OH)2溶液时,氢氧根离子先和铝离子反应生成Al(OH)3沉淀,后和铵根离子反应生成一水合氨,当铵根离子完全反应后,氢氧根离子和Al(OH)3反应生成偏铝酸根离子;
C.水的电离是吸热反应,升高温度促进水电离;
D.除去CuSO4溶液中的Fe3+,要使铁离子除去但不能除去铜离子,根据溶液pH与产生沉淀的关系知,当pH=4时氢氧化铁完全沉淀.
解答 解:A.n(FeI2)=0.1L×1mol/L=0.1mol,n( I-)=0.2mol、n(Fe2+)=0.1mol,碘离子还原性大于亚铁离子,所以碘离子先被氯气氧化、后亚铁离子被氯气氧化,发生的离子反应方程式分别为2 I-+Cl2=I2+2Cl-、2Fe2++Cl2=2Cl-+2Fe3+,0.2mol碘离子完全反应需要0.1mol氯气、0.1mol亚铁离子完全反应需要0.05mol氯气,所以图象正确,故A正确;
B.加入Ba(OH)2溶液时,OH-先和Al3+反应生成Al(OH)3沉淀,后和铵根离子反应生成一水合氨,当铵根离子完全反应后,OH-和Al(OH)3反应生成偏铝酸根离子,但生成Al(OH)3沉淀消耗NaOH的体积是Al(OH)3转化为偏铝酸钠体积的3倍,所以该图象错误,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,所以图象正确,故C正确;
D.除去CuSO4溶液中的Fe3+,要使铁离子除去但不能除去铜离子,根据溶液pH与产生沉淀的关系知,当pH=4时氢氧化铁完全沉淀,可以加入CuO降低溶液的pH且不引进杂质,故D正确;
故选B.
点评 本题考查较综合,涉及物质之间的反应、除杂、水的电离等知识点,明确物质性质、物质之间反应关系式是解本题关键,注意AB中离子反应先后顺序,为易错点.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
| A. | 酸性KI淀粉溶液在空气中久置后变蓝:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 铅蓄电池充电时阴极质量减轻:PbSO4+2e-=Pb+SO42- | |
| D. | 明矾与足量Ba(OH)2溶液混合有沉淀出现:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
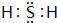 .
.