题目内容
将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后下列说法正确的是( )
| A、18O存在于所有物质里 |
| B、18O存在于乙醇和乙酸乙酯里 |
| C、18O存在于乙醇和水里 |
| D、有的乙醇分子可能不含18O |
考点:化学反应的可逆性
专题:化学平衡专题
分析:羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢.
解答:
解:乙酸与乙醇反应甲酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以乙酸与乙醇反应方程式为CH3COOH+CH3CH218OH
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中.
故选B.
| 浓硫酸 |
| △ |
故选B.
点评:本题考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.

练习册系列答案
相关题目
下列事实或现象与胶体性质无关的是( )
| A、三氯化铁溶液中加入NaOH溶液出现红褐色沉淀 |
| B、煮沸的 FeCl3溶液冷却后,用一束光照射,有一条光的通路 |
| C、胶态金属氧化物分散于玻璃中制成有色玻璃 |
| D、明矾可以用来净水 |
在实验室中,对下列事故或药品的处理正确的是( )
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,不能用泡沫灭火器灭火 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、含硫酸的废液倒入水槽,用水冲入下水道 |
某混合溶液中所含的离子浓度如下表,则Mn+及a值可能为( )
| 所含离子 | NO3- | SO42- | H+ | Na+ | Mn+ |
| 浓度(mol/L) | 4 | 3.5 | 3 | 5 | a |
| A、Mg2+、2 |
| B、Ba2+、1.5 |
| C、Al3+、0.5 |
| D、K+、3 |
下列叙述正确的是( )
| A、电能是一级能源 |
| B、水力是二级能源 |
| C、天然气是二级能源 |
| D、潮汐能是一级能源 |
下列条件的变化对醋酸的电离常数产生影响的是( )
| A、增大醋酸的浓度 |
| B、向溶液中加水 |
| C、增大压强 |
| D、升高温度 |
下列各组物质中,所含分子数相同的是( )
| A、10g H2和10g O2 |
| B、5.6LN2(标准状况)和11g CO2 |
| C、18g H2O和0.5mol Br2 |
| D、224mL H2(标准状况)和0.1mol N2 |
下列离子方程式正确的是( )
| A、Ba(OH)2溶液和H2SO4溶液反应 Ba2++SO42-═BaSO4↓ |
| B、钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na |
| D、Fe和H2SO4反应 2Fe+6H+═2Fe3++3H2↑ |
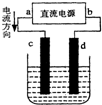 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、d为阳极 |
| B、将淀粉KI试纸的玻璃棒靠近d处一段时间会变蓝色 |
| C、电解过程中转移0.2mol电子,d电极质量增加6.4克 |
| D、电解过程中,铜离子向C极移动 |