题目内容
3.如图中,A是氯气的发生装置,B、C是净化气体的装置,B装置中装有饱和食盐水,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
(1)上述装置中有一处错误,请指出是B处(用字母表示).
(2)B装置的作用是除去Cl2中混有的HCl气体,C装置中需要加入浓H2SO4.
(3)写出A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,写出D中发生反应的化学方程式2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3 .
(4)如果A中产生氯气3.36L(标准状况),请计算:消耗MnO2的物质的量0.15mol,被氧化的HCl的物质的量0.3mol.
分析 (1)实验制备氯气中含杂质气体氯化氢和水蒸气,洗气装置除杂质要遵循长进短出;
(2)根据混合气体的成分及杂质的性质分析;
(3)根据氯气的性质判断生成物,从而写出方程式,制备氯气是固体二氧化锰和浓盐酸加热反应生成,氯气和铁反应生成氯化铁;
(4)在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,1mol氧化剂反应转移2mole-,根据化学方程式判断MnO2与Cl2的物质的量关系,根据Cl2的物质的量计算MnO2的物质的量,进而计算MnO2的质量,根据中反应化合价的变化判断被氧化的HCl的物质的量.
解答 解:(1)B装置是除去氯气中含杂质气体氯化氢,装置中导管短进长出,洗气装置除杂质要遵循长进短出,所以B装置错误;故答案为:B;
(2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体;水蒸气和铁在高温的条件下反应干扰实验,利用浓硫酸的吸水性,且不和氯气反应,用浓硫酸干燥氯气,
故答案为:除去Cl2中混有的HCl气体;浓H2SO4;
(3)A中发生的反应是二氧化锰氧化浓盐酸生成氯气,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3 ;
(4)由反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O系数比得:n(MnO2)=n(Cl2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,由反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O系数比得:被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.15mol=0.3mol,
故答案为:0.15mol;0.3mol.
点评 本题考查了氯气的实验室制备原理、装置、杂质气体的处理,考查了化学方程式的书写,掌握氯气及其化合物性质是解答的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| A. | HCl KCl | B. | CO2 SiO2 | C. | NH4Cl CCl4 | D. | NaOH Na2O2 |
| A. | 油脂没有固体的熔点,因为油脂是混合物 | |
| B. | 油脂是由高级脂肪酸和甘油所生成的酯 | |
| C. | 油脂可以在酸性或碱性条件下水解 | |
| D. | 油脂都不能使溴水褪色 |
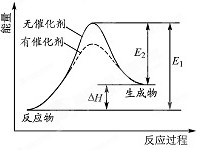 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
| A. | 电负性:O>F | B. | 第一电离能:K>Na | ||
| C. | 未成对电子数:N>C | D. | o-键数:C2H2>CH4 |
| A. | 燃料的燃烧反应、酸碱中和反应均是放热反应 | |
| B. | 化学反应释放或吸收能量的多少与反应物或产物的量无关 | |
| C. | 反应物的总能量小于生成物的总能量的反应是放热反应 | |
| D. | 放热反应一定不需要加热就能发生 |