题目内容
部分弱酸的电离常数如下表:
则下列有关说法正确的是( )
| 弱酸 | HF | HClO | H2CO3 |
| 电离常数 25℃ | 3.53×10-4 | 2.95×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、2ClO-+H2O+CO2=2HClO+CO22- |
| B、等物质的量浓度的 NaHCO3 和 NaClO 的混合溶液中,c(HCO3-)<c(ClO-) |
| C、等物质的量浓度的 NaHCO3 溶液和 Na2CO3 溶液中离子数目一定不相同 |
| D、等物质的量浓度的 NaF 和 NaClO 溶液中所含离子总浓度前者大于后者 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、化学反应符合强酸制弱酸的规律;
B、根据越弱越水解规律确定离子浓度的大小;
C、根据水解原理来确定离子数目的大小关系;
D、根据电荷守恒结合溶液的酸性强弱来确定溶液中所含离子总浓度的大小.
B、根据越弱越水解规律确定离子浓度的大小;
C、根据水解原理来确定离子数目的大小关系;
D、根据电荷守恒结合溶液的酸性强弱来确定溶液中所含离子总浓度的大小.
解答:
解:A、根据表中数据,酸性H2CO3>HClO>HCO3-,次氯酸可以和碳酸根离子反应得到次氯酸跟和碳酸氢根离子,故A错误;
B、根据表中数据,酸性H2CO3>HClO>HCO3-,等物质的量浓度的NaHCO3 和 NaClO 的混合溶液中,次氯酸根离子的水解程度大,所以c(HCO3-)>c(ClO-),故B错误;
C、等物质的量浓度的 NaHCO3 溶液和 Na2CO3溶液中碳酸根离子水解程度大于碳酸氢根,但是离子数目减小的多,同时生成的离子数目增加的也多,有可能相等,故C错误;
D、等物质的量浓度的 NaF和NaClO溶液中阴离子的总浓度都等于钠离子和氢离子的浓度和,钠离子浓度相等,酸性HF强于HClO,所以次氯酸钠的碱性强,氢离子浓度小,故所含离子总浓度前者大于后者,故D正确.
故选D.
B、根据表中数据,酸性H2CO3>HClO>HCO3-,等物质的量浓度的NaHCO3 和 NaClO 的混合溶液中,次氯酸根离子的水解程度大,所以c(HCO3-)>c(ClO-),故B错误;
C、等物质的量浓度的 NaHCO3 溶液和 Na2CO3溶液中碳酸根离子水解程度大于碳酸氢根,但是离子数目减小的多,同时生成的离子数目增加的也多,有可能相等,故C错误;
D、等物质的量浓度的 NaF和NaClO溶液中阴离子的总浓度都等于钠离子和氢离子的浓度和,钠离子浓度相等,酸性HF强于HClO,所以次氯酸钠的碱性强,氢离子浓度小,故所含离子总浓度前者大于后者,故D正确.
故选D.
点评:本题考查学生盐的水解规律的应用以及弱电解质的电离平衡常数的应用知识,综合性强,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有两种只含C、H两种元素的有机物混合气体0.1mol,完全燃烧生成0.12molCO2和0.2molH2O,则该混合气体中( )
| A、一定含有甲烷 |
| B、一定含有乙烯 |
| C、可能含有甲烷 |
| D、不能确定 |
下列叙述不正确的是( )
| A、苯与氢气反应属于加成反应 |
| B、苯与硝酸的反应是加成反应 |
| C、苯与液溴生成溴苯 |
| D、苯能够萃取溴水中的溴 |
下列有机物检验方法正确的是( )
| A、取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 |
| B、淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,来检验葡萄糖 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、用新制CaO检验乙醇中是否含有水分 |
对相同质量的N2与NO作比较,正确的是( )
| A、所含的分子数相等 |
| B、在同温同压下,V(N2)═V(NO) |
| C、所含的原子数不相等 |
| D、在同温同体积下,p(N2)<p(NO) |
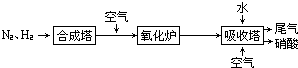
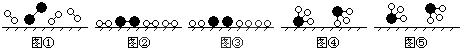
 、
、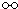 、
、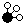 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是