题目内容
7.已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为分子晶体.P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为HPO3>H3PO4>H3PO3.(用化学式填写)分析 氯化铁熔沸点较低,应为分子晶体;同种元素含氧酸,该元素化合价越高,其酸性越强,非羟基氧越多,酸性越强,据此分析.
解答 解:FeCl3的沸点:319℃,熔点:306℃,熔沸点较低,应属于分子晶体;
H3PO4、HPO3、H3PO3中P元素化合价依次为+5、+5、+3,H3PO4、HPO3中非羟基氧依次为1、2,元素化合价越高,其酸性越强,非羟基氧越多,酸性越强,故酸性HPO3>H3PO4>H3PO3,
故答案为:分子晶体;HPO3>H3PO4>H3PO3.
点评 本题考查了晶体类型的判断和晶体的物理性质、含氧酸酸性强弱的判断等,题目难度不大,侧重于基础知识的考查,注意把握含氧酸酸性强弱的判断方法.

练习册系列答案
相关题目
18.对于淀粉和纤维素的叙述,正确的是( )
| A. | 两者都能水解生成葡萄糖 | |
| B. | 两者都是天然高分子化合物 | |
| C. | 因为都是多糖,所以都具有甜味 | |
| D. | 因为具有相同的分子式(C6H10O5)n,所以互为同分异构体 |
12.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为1:3的是( )
| A. | 苯 | B. | 乙酸乙酯 | C. | 对二甲苯 | D. | 乙醛 |
19.把a,b,c,d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a,b相连时,a为负极;c,d相连时,d上产生大量气泡;a,c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为( )
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
16.下列关于常见有机物的说法正确的是( )
| A. | 甲烷、乙烯和苯都可以从化石燃料中获得,都能使溴水褪色 | |
| B. | 乙烯和苯分子都存在碳碳双键,因而都能发生加成反应和氧化反应 | |
| C. | 酸性高锰酸钾溶液既能鉴别乙烷和乙烯,也能除去乙烷中的乙烯,得到纯净的乙烷 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 |
16.有甲、乙两个装置,下列说法错误的是( )


| A. | 甲、乙装置中,Zn的质量均减小 | B. | 甲、乙装置中,Cu上均有气泡产生 | ||
| C. | 化学反应速率 乙>甲 | D. | 甲中H+移向Zn,乙中SO42-移向Zn |
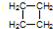 .
.