题目内容
2.H-可以跟NH3反应,H-+NH3═NH2$_2^-$+H2,根据该反应事实,可以得出的正确结论是( )| A. | NH3具有还原性 | B. | H-是很强的还原剂 | ||
| C. | H2是氧化产物,NH2$_2^-$是还原产物 | D. | 该反应属于置换反应 |
分析 由H-+NH3═NH2-+H2↑可知,H元素的化合价由-1价升高为0,H元素的化合价由+1价降低为0,以此来解答.
解答 解:A.氨气中H元素的化合价降低,则NH3有氧化性,故A错误;
B.反应中H-的H元素化合价升高,则H-是很强的还原剂,故B正确;
C.该反应中只有H元素的化合价变化,氢气既是氧化产物又是还原产物,故C错误;
D.反应物中没有单质,不属于置换反应,故D错误;
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12. 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的反应速率为0.009 mol•L-1•min-1.
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
10.下列离子方程式正确的是( )
| A. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2 | |
| C. | 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓ | |
| D. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
17.如表所示的四种元素中,W、X、Y、Z均为短周期元素,其中Y是地壳中含量最高的元素,且这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Z) | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
7.下列化学用语表达正确的是( )
| A. | CO2分子比例模型: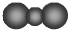 | |
| B. | 氨基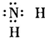 | |
| C. | 原子结构示意图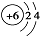 表示12C,也可以表示14C 表示12C,也可以表示14C | |
| D. | 乙炔的最简式 CH≡CH |
14.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,一定有c(Na+)═c( Cl-)+c(ClO- ) | |
| D. | 加入少量水,水的电离平衡向逆反应方向移动 |
11.下列说法中正确的是( )
①自然界中不存在游离态的硫
②将氯气通入石蕊试液先变红后褪色,将SO2通入石蕊试液也能褪色.
③二氧化硫的排放会导致光化学烟雾的产生
④二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
⑤向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
⑥浓硫酸可用来干燥SO2、CO、C12等气体
⑦将SO2通入硝酸钡溶液,生成白色沉淀BaSO3
⑧SiO2有导电性,所以可用于制光导纤维.
①自然界中不存在游离态的硫
②将氯气通入石蕊试液先变红后褪色,将SO2通入石蕊试液也能褪色.
③二氧化硫的排放会导致光化学烟雾的产生
④二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
⑤向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
⑥浓硫酸可用来干燥SO2、CO、C12等气体
⑦将SO2通入硝酸钡溶液,生成白色沉淀BaSO3
⑧SiO2有导电性,所以可用于制光导纤维.
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
12.NO是一种性质活泼的大气污染物,它能与很多物质发生反应.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知K300°C >K350°C,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.