题目内容
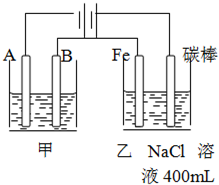 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电极反应不必写出)装置,电解液选用CuSO4溶液,则:
①A电极发生的反应类型为
②B电极的材料是
(2)实验开始时,若在乙池两边电极附近同时各滴入几滴酚酞试液,则:
①写出电解NaCl溶液总的化学方程式
②在Fe极附近观察到的现象是
(3)若甲槽电解液为CuSO4,实验中发现阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,碳棒为阳极,电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐;
(2)乙池为电解食盐水装置,反应中阴极:2H2O+2e-═H2↑+20H-,阳极:2Cl--2e-═Cl2↑;
(3)若甲为用电解原理给铁片镀铜的装置,阴极反应为Cu2++2e-═Cu,然后根据电极反应以及两个串联电解池转移电子数目相等计算.
(2)乙池为电解食盐水装置,反应中阴极:2H2O+2e-═H2↑+20H-,阳极:2Cl--2e-═Cl2↑;
(3)若甲为用电解原理给铁片镀铜的装置,阴极反应为Cu2++2e-═Cu,然后根据电极反应以及两个串联电解池转移电子数目相等计算.
解答:
解:图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,碳棒为阳极,
(1)①A为阴极,发生还原反应,B为阳极,发生氧化反应,Fe为阴极,发生还原反应,则B电极和Fe电极电子的流向由Fe到B,
故答案为:还原反应;Fe;B;
②B为粗铜,电极方程式为Cu-2e-═Cu2+,由于粗铜含有Zn等金属,活泼性比铜强,在阳极上锌、铜放电,而阴极只有铜离子放电,则溶液中铜离子浓度略有减小,
故答案为:粗铜;Cu-2e-═Cu2+;略有减少;
(2)①电解NaCl溶液总的化学方程式为2NaCl+2H2O
H2↑+2NaOH+Cl2↑,
故答案为:2NaCl+2H2O
H2↑+2NaOH+Cl2↑;
②乙池电解NaCl溶液,阴极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红,阳极生成氯气,可用湿润的淀粉碘化钾试纸检验,方法是把湿润的淀粉碘化钾放在碳棒附近,试纸变蓝色,
故答案为:溶液变红;把湿润的淀粉碘化钾放在碳棒附近,试纸变蓝色;
(3)甲槽阴极阴极反应为Cu2++2e-═Cu,阴极增重12.8g,应为铜的质量,为0.2mol,转移的电子为0.4mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.4mol时,在阳极上生成气体的物质的量为0.2mol,放出气体在标准状况下的体积为0.2mol×22.4L/mol=4.48L,
乙池阴极反应为:2H2O+2e-═H2↑+20H-,转移的电子为0.4mol时,生成0.4mol0H-离子,则电解后得到碱液的物质的量浓度为
=1mol?L-1,
故答案为:4.48;1mol?L-1.
(1)①A为阴极,发生还原反应,B为阳极,发生氧化反应,Fe为阴极,发生还原反应,则B电极和Fe电极电子的流向由Fe到B,
故答案为:还原反应;Fe;B;
②B为粗铜,电极方程式为Cu-2e-═Cu2+,由于粗铜含有Zn等金属,活泼性比铜强,在阳极上锌、铜放电,而阴极只有铜离子放电,则溶液中铜离子浓度略有减小,
故答案为:粗铜;Cu-2e-═Cu2+;略有减少;
(2)①电解NaCl溶液总的化学方程式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
②乙池电解NaCl溶液,阴极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红,阳极生成氯气,可用湿润的淀粉碘化钾试纸检验,方法是把湿润的淀粉碘化钾放在碳棒附近,试纸变蓝色,
故答案为:溶液变红;把湿润的淀粉碘化钾放在碳棒附近,试纸变蓝色;
(3)甲槽阴极阴极反应为Cu2++2e-═Cu,阴极增重12.8g,应为铜的质量,为0.2mol,转移的电子为0.4mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.4mol时,在阳极上生成气体的物质的量为0.2mol,放出气体在标准状况下的体积为0.2mol×22.4L/mol=4.48L,
乙池阴极反应为:2H2O+2e-═H2↑+20H-,转移的电子为0.4mol时,生成0.4mol0H-离子,则电解后得到碱液的物质的量浓度为
| 0.4mol |
| 0.4L |
故答案为:4.48;1mol?L-1.
点评:本题考查电解池的工作原理,题目难度不大,本题注意电极反应式的书写以及串联电解池转移电子相等的特点.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
下列关于氟氯烃的说法中,不正确的是( )
| A、氟氯烃是一类含氟和氯的卤代烃 |
| B、氟氯烃化学性质稳定,有毒 |
| C、氟氯烃大多数无色,无臭,无毒 |
| D、在平流层,氟氯烃在紫外线照射下,分解产生氯原子可引发损耗O3的循环反应 |


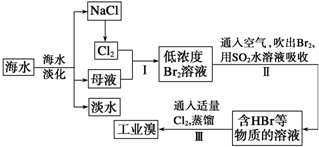
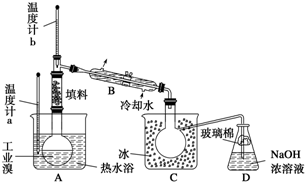
 从图中得到的正确信息是
从图中得到的正确信息是