题目内容
18.1.8g某金属的单质直接与氯气反应后,质量增加7.1g,这种金属是( )| A. | 铝 | B. | 铁 | C. | 镁 | D. | 锌 |
分析 假设该金属失去两个电子变为带两个单位正电荷的阳离子,根据转移电子守恒计算金属的物质的量,再根据M=$\frac{m}{n}$进行计算其摩尔质量,根据金属的相对原子质量确定该元素.
解答 解:假设该金属失去两个电子变为带两个单位正电荷的阳离子,n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,金属和氯气化合导致金属质量增加,则增加的质量为氯气的质量,根据转移电子守恒得n(金属)×2=0.1mol×2×[0-(-1)],n(金属)=0.1mol,金属的摩尔质量=$\frac{1.8g}{0.1mol}$=18g/mol,摩尔质量在数值上等于其相对原子质量,所以该金属的相对原子质量为18×$\frac{3}{2}$=27,Al的相对原子质量为27,
故选A.
点评 本题考查了物质的量的有关计算,根据转移电子守恒计算金属的物质的量,再根据物质的量、质量、摩尔质量及摩尔质量和相对原子质量关系进行计算,题目难度不大,注意:金属失去两个电子时,钠的相对原子质量、铝的相对原子质量要进行改变,为易错点.

练习册系列答案
相关题目
8.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  实验室制取乙烯 | B. | 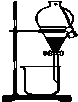 利用酒精萃取碘水中的I2单质 | ||
| C. | 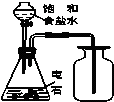 实验室制取乙炔并收集 | D. | 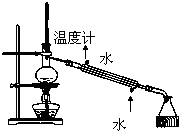 石油的分馏实验 |
9.CO是甲酸(HCOOH)的酸酐,将甲酸与下列某物质混合可制取CO,该物质是( )
| A. | 浓硫酸 | B. | 碳粉 | C. | NaOH固体 | D. | Na2O2粉末 |
13.下列说法中,正确的是( )
| A. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| B. | 人们可以利用化学变化制造出新的分子和原子 | |
| C. | 门捷列夫提出的原子学说,为现代化学的发展奠定了坚实的基础 | |
| D. | 化学科学在未来还将继续推动材料科学的发展,使各种新功能材料的生产成为可能 |
3.如图所示的装置可用于( )


| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐Na4S2O3,在酸性条件下可以产生S.下列关于混盐
Na4S2O3的有关判断不正确的是( )
Na4S2O3的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
8.在CH3COOH溶液中存在如下平衡:CH3COOH?CH3COO-+H+.加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
| A. | 加水 | B. | CH3COONa固体 | C. | 升温 | D. | NaCl固体 |