题目内容
在25℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液,在所得的溶液中,离子浓度关系正确的是. ( )
| A、c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| B、c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| C、c(CH3COO-)+c(OH-)-c(H+)=0.008 mol/L |
| D、c(H+)=0.002 mol/L |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:二者混合后,溶液中的溶质为0.008mol/LCH3COONa、0.002mol/LNaCl、0.002mol/LCH3COOH,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:A.二者混合后,溶液中的溶质为0.008mol/LCH3COONa、0.002mol/LNaCl、0.002mol/LCH3COOH,醋酸电离程度大于醋酸根离子水解程度,结合物料守恒知c(Cl-)<c(CH3COO-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.01 mol/L,故B正确;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒、物料守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)-c(Cl-)=0.01 mol/L-0.002mol/L=0.008mol/L,故C正确;
D.溶液中存在0.002mol/LCH3COOH,醋酸是弱电解质,电离程度较小,所以c(H+)<0.002 mol/L,故D错误;
故选BC.
B.溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.01 mol/L,故B正确;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒、物料守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)-c(Cl-)=0.01 mol/L-0.002mol/L=0.008mol/L,故C正确;
D.溶液中存在0.002mol/LCH3COOH,醋酸是弱电解质,电离程度较小,所以c(H+)<0.002 mol/L,故D错误;
故选BC.
点评:本题考查离子浓度大小比较,根据物质物质的量的相对大小确定溶液中的溶质,再结合物料守恒、电荷守恒分析解答,易错选项是C.

练习册系列答案
相关题目
下列实验操作中,正确的是( )
| A、蒸发溶液时,边加热加搅拌,直至蒸发皿内的液体蒸干 |
| B、量取25.00LKMnO4溶液时,应选择酸式滴定管 |
| C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4注入容量瓶中加水稀释,边注入边搅拌 |
| D、配制一定物质的量浓度的溶液时,若未洗涤烧杯和玻璃棒,则会导致所配溶液的物质的量浓度偏高 |
向含n mol 硫酸铝的溶液中加入m mol NaOH溶液,观察到的现象是先有白色沉淀生成,后部分溶解,则生成Al(OH)3沉淀的物质的量是( )
| A、(8n-m)mol |
| B、(4m-n)mol |
| C、(4n-m)mol |
| D、(7n-m)mol |
下列各项内容中,属于化学科学研究内容的是( )
| A、利用指南针确定航海方向 |
| B、培育新品种,增加农作物产量 |
| C、综合利用石油,合成优良人造纤维 |
| D、设计新程序,开发电脑新功能 |
化学与人类生产、生活、社会可持续发展密切相关.下列有关说法正确的是( )
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
下列说法正确的是( )
A、
| ||||
B、
| ||||
C、Cl-的粒子结构示意图为 | ||||
| D、不同的核素属于不同的元素 |
从葡萄籽中提取的原花青素结构为:有关原花青素的下列说法不正确的是( )
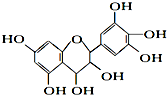

| A、该物质既可看作醇类,也可看作酚类 |
| B、1mol该物质可与4mol Br2反应 |
| C、1mol该物质可与7mol Na反应 |
| D、1mol该物质可与7mol NaOH反应 |