题目内容
3.下列叙述不能证明乙酸是弱电解质的是( )| A. | 常温时0.1mol/L乙酸溶液的pH=3 | |
| B. | 常温时0.1mol/L的乙酸钠溶液能使红色石蕊试纸变蓝 | |
| C. | 0.1mol/L的乙酸溶液与同体积0.1mol/L的氢氧化钠溶液恰好反应 | |
| D. | 0.1mol/L乙酸溶液的导电性比0.1mol/L盐酸弱 |
分析 弱电解质的证明,是基于与强电解质对比进行的,弱电解质与强电解质最大的区别就是:弱电解质存在电离平衡,而强电解质不存在电离平衡;因此只要证明乙酸在溶液中部分电离、存在电离平衡,即可证明乙酸弱电解质,据此进行解答.
解答 解:A、常温时,测得0.1 mol•L-1乙酸溶液的pH约为3,溶液中氢离子浓度为0.001mol/L,说明乙酸在溶液中部分电离,存在电离平衡,所以乙酸为弱电解质,故A不选;
B.常温时0.1mol/L的乙酸钠溶液能使红色石蕊试纸变蓝,说明乙酸钠溶液显碱性,证明乙酸钠为为强碱弱酸盐,从而证明了乙酸为弱电解质,故B不选;
C.0.1mol/L的乙酸溶液与同体积0.1mol/L的氢氧化钠溶液恰好反应,因为二者物质的量相等,根据化学方程式会恰好完全反应,不能说明乙酸是弱电解质,故C选;
D、乙酸和盐酸都是一元酸,相同条件下、相同浓度的两溶液,导电性乙酸的小于盐酸,说明乙酸溶液中离子浓度小于盐酸,证明乙酸在溶液中部分电离,所以乙酸为弱电解质,故D不选;
故选C.
点评 本题考查了强弱电解质的判断,题目难度不大,也是高考中的常见题型,对学生的思维能力提出了较高的要求,有利于培养学生的逻辑推理能力和逆向思维能力;该题的关键是目前弱电解质的电离平衡特点以及判断依据,然后结合题意灵活运用即可.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
13.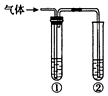 用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
 用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( ) | 实验目的 | ②中的试剂 | |
| A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
| B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
| C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
| D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
14.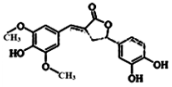 天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
 天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )| A. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 | |
| B. | 1 mol该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含5 mol Br2的浓溴水反应 | |
| D. | 该化合物分子中含有三种含氧官能团 |
11.下列实验操作及对应解释或结论正确的是( )
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 原溶液中一定含有SO42- |
| B | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
18.中华民族有着光辉灿烂的发明史,下列发明创造的主要原理不涉及化学变化的是( )
| A. | 黑火药的使用 | B. | 用铁矿石炼铁 | ||
| C. | 打磨磁石制备指南针 | D. | 造纸术的使用 |
8.下列各图所示的分子结构模型中,分子式为C6H6的是( )
| A. |  | B. |  | C. |  | D. |  |
15.将浓度均为0.2mol/L的CH3COOH和CH3COONa溶液等体积混合,混合液呈弱酸性,其中有三种微粒的浓度非常接近,这三种微粒是( )
| A. | CH3COO- Na+ CH3COOH | B. | CH3COO- CH3COOH H+ | ||
| C. | CH3COOH OH- H+ | D. | CH3COO- OH- H+ |
12.不能利用如图实验装置完成的实验是( )


| A. | 制取乙烯 | B. | 制取O2 | C. | 制取CO2 | D. | 制取乙炔 |
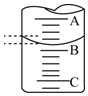 甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.
甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.