题目内容
16.下列实验操作中,正确的是( )| A. | 测定硫酸铜晶体中结晶水含量时,灼烧至固体变白即可 | |
| B. | 硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 | |
| C. | 滴定管中标准液在零刻度以上 | |
| D. | 滴定管用蒸馏水洗净后直接装入标准盐酸溶液 |
分析 A.灼烧时易导致硫酸铜分解、晶体飞溅;
B.加热时需要用小火缓慢加热,避免硫酸铜晶体飞溅,影响测定结果;
C.滴定管中的标准液必须在0刻度以下;
D.滴定管在装入标准液前必须润洗,否则标准液被蒸馏水稀释,影响测定结果.
解答 解:A.硫酸铜结晶水含量测定时,需用小火缓慢加热,不能灼烧,防止晶体飞溅、硫酸铜分解,故A错误;
B.硫酸铜结晶水含量测定时,为了防止晶体飞溅,需用小火缓慢加热,不可灼烧,故B正确;
C.中和滴定时,0刻度以上无法读出溶液体积,所以滴定管中标准液在零刻度以下,故C错误;
D.滴定管用蒸馏水洗净后,应该先用标准液润洗,然后再装入标准盐酸溶液,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见化学实验基本操作方法为解答关键,注意掌握硫酸铜晶体中结晶水测定方法及中和滴定方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
6.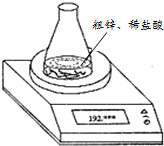 实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
(1)写出锌和盐酸反应的化学方程式Zn+2HCl→ZnCl2+H2↑.
(2)不必作第6次读数的原因是第五次数据已达恒重,说明反应完全了.计算粗锌的质量分数时,需用到的数据有试样质量(或1.950 g)、锥形瓶加盐酸的质量(或190.720 g)、第4(或5)次读数(或192.610 g).
(3)数据处理结束后,同学们发现他们的测定结果明显偏大(填偏大、偏小或不变).他们在锥形瓶上增加一个装有碱石灰的干燥管后,再次实验,得到了较正确的结果.干燥管的作用有吸收水蒸气、吸收氯化氢气体.
 实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)| 读数次数 | 质量(g) | |
| 锥形瓶 + 稀盐酸 + 粗锌 | 第1次 | 192.655 |
| 第2次 | 192.636 | |
| 第3次 | 192.620 | |
| 第4次 | 192.610 | |
| 第5次 | 192.610 |
(2)不必作第6次读数的原因是第五次数据已达恒重,说明反应完全了.计算粗锌的质量分数时,需用到的数据有试样质量(或1.950 g)、锥形瓶加盐酸的质量(或190.720 g)、第4(或5)次读数(或192.610 g).
(3)数据处理结束后,同学们发现他们的测定结果明显偏大(填偏大、偏小或不变).他们在锥形瓶上增加一个装有碱石灰的干燥管后,再次实验,得到了较正确的结果.干燥管的作用有吸收水蒸气、吸收氯化氢气体.
7.设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)( )
| A. | 1.8g的NH4+离子中含有nA个电子 | |
| B. | 标准状况下,22.4L水中含有nA个H2O分子 | |
| C. | 常温常压下,33.6 L Cl2中含有1.5nA个C12分子 | |
| D. | 1L1 mol•L-1 Na2 CO3溶液中有2nA个Na+和nA个CO32- |
4.金属具有导电性、导热性、延展性等共性.其中金属具有延展性的主要原因是( )
| A. | 金属原子半径都较大,最外层电子数较少 | |
| B. | 金属受外力作用时,层间彼此滑动,但金属离子与自由电子仍保持其较强的作用 | |
| C. | 金属中的大量自由电子,受外力作用时,运动速度加快 | |
| D. | 自由电子能迅速传递能量 |
11.在实验室配制氯化亚铁溶液时,如果出现浑浊,采取的最好措施是( )
| A. | 加入锌粒 | B. | 加入铁钉 | C. | 加入盐酸 | D. | 加入硫氰化钾 |
1.物质的量浓度相同的下列物质的水溶液,pH最小的是( )
| A. | Na2CO3 | B. | NH4Cl | C. | H2SO4 | D. | CH3COOH |
8.某烷烃的分子式为C5H12,则其同分异构体有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
5. 乙醛在氧化铜催化剂的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体).已知在60℃-80℃时用双链大气球鼓入空气即可发生乙醛的氧化反应,联系鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体).已知在60℃-80℃时用双链大气球鼓入空气即可发生乙醛的氧化反应,联系鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测反应液的温度;
当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油.
(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是有利于乙酸的冷凝收集.
(4)对C中产品进行蒸馏时,蒸馏烧瓶中装加入少量D,以出去其中含有的少量水.
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCL2
(5)以下区分乙酸精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,震荡后观察实验现象.
 乙醛在氧化铜催化剂的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体).已知在60℃-80℃时用双链大气球鼓入空气即可发生乙醛的氧化反应,联系鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体).已知在60℃-80℃时用双链大气球鼓入空气即可发生乙醛的氧化反应,联系鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8 | 117.9 | 290 | 197.2 | 100 |
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测反应液的温度;
当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油.
(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是有利于乙酸的冷凝收集.
(4)对C中产品进行蒸馏时,蒸馏烧瓶中装加入少量D,以出去其中含有的少量水.
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCL2
(5)以下区分乙酸精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,震荡后观察实验现象.
10.下列离子方程式正确的是( )
| A. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+H2O+CO2↑ | |
| C. | 用饱和纯碱溶液溶解苯酚:CO32-+2C6H5OH→2C6H5O-+H2O+CO2↑ | |
| D. | Fe(NO3)2溶液中滴加稀硫酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |