题目内容
向10ml 0.1mol/l的Na[Al(OH)4]溶液中滴加0.1mol/l的HCl溶液,生成沉淀的量与加入的盐酸体积的关系如图.
(1)写出OA段的离子方程式 .
(2)写出AB段的化学方程式 .
(3)OB段反应共消耗 ml盐酸溶液,此过程中生成沉淀最多时,沉淀物质的量是 mol,此时消耗的盐酸是 mL.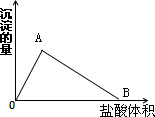
(1)写出OA段的离子方程式
(2)写出AB段的化学方程式
(3)OB段反应共消耗

考点:离子方程式的有关计算
专题:计算题
分析:(1)由图可知,从开始至加入HCl溶液,沉淀增多,此时发生的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O.
(2)由图可知,AB段沉淀减少,Al(OH)3被盐酸溶解,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O;
(3)据[Al(OH)4]-+H+=Al(OH)3↓+H2O计算沉淀物质的量,此时消耗的盐酸的量;上面的两个反应写出:[Al(OH)4]-与H+反应的总比例计算:[Al(OH)4]-~4H+.
(2)由图可知,AB段沉淀减少,Al(OH)3被盐酸溶解,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O;
(3)据[Al(OH)4]-+H+=Al(OH)3↓+H2O计算沉淀物质的量,此时消耗的盐酸的量;上面的两个反应写出:[Al(OH)4]-与H+反应的总比例计算:[Al(OH)4]-~4H+.
解答:
解:(1)由图可知,从开始至加入HCl溶液,沉淀增多,此时发生的反应为[Al(OH)4]-+H+=Al(OH)3↓+H2O,
故答案为::[Al(OH)4]-+H+=Al(OH)3↓+H2O;
(2)由图可知,AB段沉淀减少,Al(OH)3被盐酸溶解,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O
故答案为:Al(OH)3+3HCl=AlCl3+3H2O;
(3)Na[Al(OH)4]物质的量为:0.01L×0.1mol/l=0.001mol,
[Al(OH)4]-+H+=Al(OH)3↓+H2O
0.001mol 0.001mol 0.001mol
生成沉淀最多时,消耗的盐酸体积是:
=0.01L=10mL
上面的两个反应写出[Al(OH)4]-与H+反应的总比例计算:[Al(OH)4]-~4H+
0.001mol 0.004mol
OB段反应共消耗消耗的盐酸体积是:
=0.04L=40mL,
故答案为:40;0.001;10.
故答案为::[Al(OH)4]-+H+=Al(OH)3↓+H2O;
(2)由图可知,AB段沉淀减少,Al(OH)3被盐酸溶解,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O
故答案为:Al(OH)3+3HCl=AlCl3+3H2O;
(3)Na[Al(OH)4]物质的量为:0.01L×0.1mol/l=0.001mol,
[Al(OH)4]-+H+=Al(OH)3↓+H2O
0.001mol 0.001mol 0.001mol
生成沉淀最多时,消耗的盐酸体积是:
| 0.001mol |
| 0.1mol/L |
上面的两个反应写出[Al(OH)4]-与H+反应的总比例计算:[Al(OH)4]-~4H+
0.001mol 0.004mol
OB段反应共消耗消耗的盐酸体积是:
| 0.004mol |
| 0.1mol/L |
故答案为:40;0.001;10.
点评:本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A、烧碱、液态氧、碘酒 |
| B、生石灰、熟石灰、白磷 |
| C、干冰、铜、氯化氢 |
| D、空气、氮气、胆矾 |
金属钾在氧气中燃烧能生成超氧化钾(KO2),KO2与CO2或水作用均生成O2.现将一定量钠钾合金在足量氧气中燃烧,将反应产物置于水中并通入足量的CO2,充分反应后,最多放出O2的体积是最多吸收CO2的体积的
,则原钠钾合金中钠与钾的质量之比为( )
| 1 |
| 3 |
| A、23:36 |
| B、46:39 |
| C、115:39 |
| D、23:78 |
在加热条件下,将24gCuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到澄清石灰水中,得到白色沉淀40g.下列有关叙述正确的是( )
| A、原反应物中CuO与Fe2O3物质的量的比为1:1. |
| B、反应后所得CO2的质量为40g |
| C、参加反应的CO的质量为11.2g |
| D、原反应物中CuO与Fe2O3物质的量的比为1:2. |

