题目内容
某化肥厂用NH3制备NH4NO3.已知:由NH3制NO时氨气损失10%,NO制HNO3的产率是90%,HNO3跟NH3反应生成NH4NO3.(不考虑生产中其它损耗)计算:
①制HNO3所用去的氨气的质量占总耗氨的质量分数是多少?
②1t氨气最多可制备NH4NO3多少?
①制HNO3所用去的氨气的质量占总耗氨的质量分数是多少?
②1t氨气最多可制备NH4NO3多少?
考点:化学方程式的有关计算
专题:计算题
分析:①假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,根据原子守恒计算制备硝酸的氨气,每一步损失率、利用率都以氨气计算;
②根据①中质量分数计算与硝酸反应的氨气的质量,再根据HNO3+NH3=NH4NO3计算制备NH4NO3的质量.
②根据①中质量分数计算与硝酸反应的氨气的质量,再根据HNO3+NH3=NH4NO3计算制备NH4NO3的质量.
解答:
解:①假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,制备的硝酸为1mol,令制备硝酸的氨气为xmol,每一步损失率、利用率都以氨气计算,根据原子守恒,xmol×(1-10%)×90%=1mol,解得x=
,故制HNO3所用去的氨气的质量占总耗氨的质量分数是
×100%=55.2%,
答:制HNO3所用去的氨气的质量占总耗氨的质量分数是55.2%.
②设生成NH4NO3的质量为yt,则:
NH3+HNO3=NH4NO3
17 80
1t×(1-55.2%) yt
所以17:80=1t×(1-55.2%):yt
解得y=2.11
答:1t氨气最多可制备NH4NO3为2.11t.
| 100 |
| 81 |
| ||
1mol+
|
答:制HNO3所用去的氨气的质量占总耗氨的质量分数是55.2%.
②设生成NH4NO3的质量为yt,则:
NH3+HNO3=NH4NO3
17 80
1t×(1-55.2%) yt
所以17:80=1t×(1-55.2%):yt
解得y=2.11
答:1t氨气最多可制备NH4NO3为2.11t.
点评:本题考查多步反应的有关计算,侧重考查学生分析思维能力,注意利用守恒思想计算,也可以利用关系式计算,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应属于放热反应的是( )
| A、NaOH溶于水 | ||||
B、C+CO2
| ||||
| C、KClO3受热分解 | ||||
| D、Al与稀盐酸反应 |
分别向下列物质的溶液中加入少量的Na2O2固体,不会出现浑浊的是( )
| A、CuCl2溶液 |
| B、FeCl3溶液 |
| C、饱和Ca(OH)2溶液 |
| D、NaHCO3溶液 |
下列变化属于加成反应的是( )
| A、乙烯通过酸性KMnO4溶液 |
| B、乙醇和浓硫酸共热 |
| C、乙炔使溴水褪色 |
| D、苯酚与浓溴水混合 |
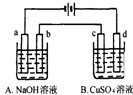 按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )
按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )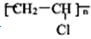 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.