题目内容
Ⅰ.请根据以下装置回答相关问题

(1)图甲是一套进行_________操作的装置,可以除去粗苯甲酸中所含的______杂质。
(2)利用图乙装置来证明醋酸、碳酸、苯酚酸性的相对强弱时,实验过程中,苯酚钠溶液中所出现的实验现象是_________________________________________________。
该实验中存在的缺陷是未除去__________(填化学式下同)中可能混有的___________
(3)图丙是做乙醛的银镜反应前配制银氨溶液的实验操作图。配制过程中,试管内发生变化的现象是______________________________。配好银氨溶液后,向其中加入乙醛进行银镜反应时,为了获得良好的实验效果,对试管采用的加热方式是_____________。乙醛发生银镜反应的化学方程式是___________________________________________。
Ⅱ.某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现__________色和___________色交替的现象。
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的
作用依次为____________________,_____________________________________
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)




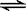 2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是
2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是