题目内容
9.将10g CO2和O2的混合气体,通过装有足量过氧化钠的干燥管,反应后干燥管的总质量增加了5.6g,则原混合气体中O2的质量分数为( )| A. | 12% | B. | 32% | C. | 44% | D. | 88% |
分析 CO2和O2的混合气体,通过装有足量Na2O2的干燥管,发生反应:2Na2O2+2CO2=2Na2CO3+O2,根据固体质量增重,利用差量法计算二氧化碳的质量,进而计算氧气的质量分数.
解答 解:设混合气体中二氧化碳的质量为m,则:
2Na2O2+2CO2=2Na2CO3+O2 固体质量增重△m
88 88-32=56
m 5.6g
所以m=$\frac{5.6g×88}{56}$=8.8g
则氧气的质量为10g-8.8g=1.2g
故氧气的质量分数为$\frac{1.2g}{10g}$×100%=12%
故选:A.
点评 本题考查化学方程式有关计算、混合物有关计算,难度不大,注意利用差量法解答.

练习册系列答案
相关题目
20.下列反应的离子方程式的书写正确的是( )
| A. | 镁粉与稀醋酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
4.给定条件下,下列选项中所示的物质间转化能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | B. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | ||
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{20}}{→}$H2SO4 |
14.下列说法不正确的是( )
| A. | 胶体一定是混合物 | |
| B. | 丁达尔效应可用于鉴别胶体和溶液 | |
| C. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于净化自来水 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其与空气形成的分散系属于胶体 |
18.能正确表示下列反应的离子方程式是( )
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 实验室制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
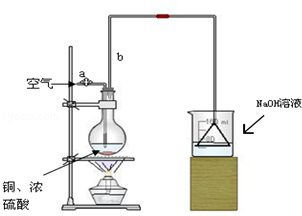 某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.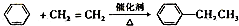
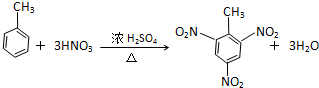 .
. .
.