题目内容
六价铬对人体有毒,含铬废水要经过化学处理后才能排放,方法是用绿矾(FeSO4?7H2O)把废水中六价铬还原成三价铬离子,再加入过量的石灰水,使铬离子生成Cr(OH)3沉淀.
(1)配平下列主要反应的化学方程式并标出电子转移的方向和数目:
H2Cr2O7+ FeSO4+ H2SO4→ Fe2(SO4)3+ Cr2(SO4)3+ H2O
(2)上述反应中的氧化产物是 ,硫酸所体现的性质
(3)处理后的沉淀中有Cr(OH)3外,还有 (用化学式表示).
(4)现在处理1×103 L含铬(+6)78mg?L-1的废水,需要绿矾 g.
(1)配平下列主要反应的化学方程式并标出电子转移的方向和数目:
(2)上述反应中的氧化产物是
(3)处理后的沉淀中有Cr(OH)3外,还有
(4)现在处理1×103 L含铬(+6)78mg?L-1的废水,需要绿矾
考点:氧化还原反应方程式的配平,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据元素化合价和电子转移之间的关系来回答;
(2)化合价升高的元素在反应中被氧化,发生氧化反应,得到氧化产物,根据硫酸纸元素化合价的变化情况来确定其性质;
(3)根据离子最终的产物来回答;
(4)依据离子方程式定量关系计算得到.
(2)化合价升高的元素在反应中被氧化,发生氧化反应,得到氧化产物,根据硫酸纸元素化合价的变化情况来确定其性质;
(3)根据离子最终的产物来回答;
(4)依据离子方程式定量关系计算得到.
解答:
解:(1)在反应中,Cr元素的化合价从+6价降低为+3价,1molH2Cr2O7共得到电子是6mol,Fe元素的化合价升高,从+2价升高到+3价,铁元素失电子,铬元素得电子,转移电子是6,所以FeSO4的前边系数是6,Fe2(SO4)3的前边系数是3,H2Cr2O7的系数是1,Cr2(SO4)3的系数是1,根据元素守恒,得到化学方程式以及电子转移情况如下:1H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+1Cr2(SO4)3+7H2O,
故答案为:1;6;6;3;1;7; ;
;
(2)铁元素的化合价升高,所以Fe2(SO4)3是氧化产物,硫酸中的元素化合价没有变化,生成对应的盐,所体现的性质是酸性,故答案为:Fe2(SO4)3;酸性;
(3)亚铁离子被氧化为铁离子,铁离子可以和氢氧化钙反应生成Fe(OH)3,所以处理后的沉淀中有Cr(OH)3外,还有Fe(OH)3,故答案为:Fe(OH)3;
(4)现用上述方法处理1×103 L含铬(+6价)78mg?L-1的废水,铬元素物质的量=
=1.5mol,Cr2O72-物质的量0.75mol,则
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
1 6
0.75mol 4.5mol
需用绿矾的质量=4.5mol×278g/mol=1251g,
故答案为:1251.
故答案为:1;6;6;3;1;7;
 ;
;(2)铁元素的化合价升高,所以Fe2(SO4)3是氧化产物,硫酸中的元素化合价没有变化,生成对应的盐,所体现的性质是酸性,故答案为:Fe2(SO4)3;酸性;
(3)亚铁离子被氧化为铁离子,铁离子可以和氢氧化钙反应生成Fe(OH)3,所以处理后的沉淀中有Cr(OH)3外,还有Fe(OH)3,故答案为:Fe(OH)3;
(4)现用上述方法处理1×103 L含铬(+6价)78mg?L-1的废水,铬元素物质的量=
| 1×103L×78×10-3g/L |
| 52g/mol |
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
1 6
0.75mol 4.5mol
需用绿矾的质量=4.5mol×278g/mol=1251g,
故答案为:1251.
点评:本题涉及氧化还原方程式的配平以及方程式的计算等知识,注意电子转移和化合价变化之间的关系是关键,难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.
根据以上数据分析,下列说法正确的是( )
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A、甲的金属性比乙弱 |
| B、乙的化合价为+1价 |
| C、丙一定为非金属元素 |
| D、丁一定为金属元素 |
 小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )| A、该有机物的分子式一定为C3H6O2 |
| B、在酸性条件下水解生成两种有机产物的相对分子质量可能相等 |
| C、该有机物在碱性条件下可水解更完全 |
| D、该有机物肯定能发生银镜反应 |
鉴别NO2 和Br2蒸气,下列方法可行的是( )
| A、通入水中 |
| B、通入CCl4中 |
| C、通入NaOH溶液中 |
| D、用湿润的淀粉KI试纸检验 |
 (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式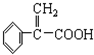 )及高聚物F.
)及高聚物F.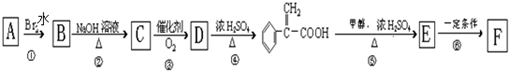
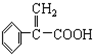 具有相同官能团且属于芳香族化合物的同分异构体有
具有相同官能团且属于芳香族化合物的同分异构体有 的任意一个同分异构体的结构简式
的任意一个同分异构体的结构简式