题目内容
8.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )| A. | 常温下,48gO3和48gO2含有的电子数目为3NA | |
| B. | 1molOH-离子中含电子数目为10 NA | |
| C. | 0.5L0.2mol•L-1的NaCl溶液中含有的Na+数是0.1 NA | |
| D. | 33.6LCO中含有的原子总数是3NA |
分析 A.臭氧和氧气都是由氧原子构成,相同质量臭氧和氧气含有氧原子数相同,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答;
B.1个氢氧根离子含有10个电子;
C.依据n=CV计算氯化钠的物质的量,1mol氯化钠含有1mol钠离子;
D.气体状况未知.
解答 解:A.臭氧和氧气都是由氧原子构成,相同质量臭氧和氧气含有氧原子数相同,48gO3和48gO2含有氧原子的物质的量为:$\frac{48g}{16g/mol}$=3mol,含有电子数为:3mol×8×NA=24NA,故A错误;
B.1个氢氧根离子含有10个电子,则1molOH-离子中含电子数目为10 NA,故B正确;
C.0.5L0.2mol•L-1的NaCl溶液中含有氯化钠物质的量为:0.5L×0.2mol/L=0.1mol,含有的Na+数是0.1 NA,
故C正确;
D.气体状况未知,Vm未知,无法计算一氧化碳物质的量和含原子数,故D错误;
故选:AD.
点评 本题考查阿伏加德罗常数应用与判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确清分子、原子、原子核内质子中子及核外电子的构成关系,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
19. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )| A. | 碳酸钠溶液 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
16.电解质是( )
| A. | 在水溶液里或溶融状态下全部电离的化合物 | |
| B. | 在水溶液里或熔融状态下能导电的化合物 | |
| C. | 可溶性盐类 | |
| D. | 导电性很强的物质 |
3.下列说法正确的是( )
| A. | 乙烯的电子式为  | B. | 乙烯的球棍模型为  | ||
| C. | 乙烯分子是平面结构 | D. | 乙烯的结构简式为CH2CH2 |
13.已知Cr2O72-、Cr3+、CH3CH2OH、CH3COOH、H+、H2O六种微粒属于一个氧化还原反应中的反应物和生成物.下列叙述中不正确的是( )
| A. | 还原产物为CH3COOH | |
| B. | 氧化剂与还原剂的物质的量之比为2:3 | |
| C. | Cr2O72-和Cr3+分别属于反应物和生成物 | |
| D. | 若把该反应设计从成原电池,则负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
20.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | Al2O3和 MgO 的熔点均很高,可用于制作耐高温材料 | |
| B. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
17.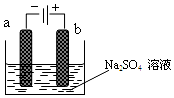 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )| A. | a电极附近呈红色,b电极附近无明显变化 | |
| B. | 逸出气体的体积,a电极的大于b电极的 | |
| C. | Na2SO4水溶液浓度逐渐增大 | |
| D. | 当电路中通过0.04mol e-时,a电极逸出气体的体积为448mL |
18.下列对于太阳能、生物质能和氢能的利用的说法不正确的是( )
| A. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 | |
| B. | 将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 | |
| C. | 生活、生成中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 | |
| D. | 垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识 |