题目内容
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途径分别对X进行如下实验探究: 途径a: 
途径b: 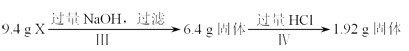
下列有关说法不正确的是( )
A.1.92g固体只含Cu
B.由Ⅰ可知X中一定存在Fe2O3和Cu
C.原混合物中m(Fe2O3):m(Cu)=1:1
D.原混合物X至少含Al2O3和SiO2中的一种,但不能进一步确认二者的存在与否
【答案】D
【解析】解:途径a:9.4gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O;Cu+2Fe3+=2Fe2++Cu2+ , SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu;结合途径b可知9.4gX和过量的氢氧化钠反应,固体质量变为6.4g,所以固体只有二氧化硅,一定没有氧化铝;途径b:9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ , 说明溶液中一定存在Fe2O3 , 则1.92g固体为铜, A.由上述分析可知,1.92g固体只含Cu,故A正确;
B.由I可知,X和过量盐酸反应生成蓝色溶液,为铜离子的颜色,但Cu和盐酸不反应,则一定含有氧化铁,和盐酸反应生成的三价铁离子和金属铜反应,即X中一定存在Fe2O3和Cu,故B正确;
C.设氧化铁的物质的量是x,金属铜的物质的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,则160x+64y=6.4,64y﹣64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化铁的质量为0.02mol×160g/mol=3.2g,金属铜的质量为0.05mol×64g/mol=3.2g,则原混合物中m(Fe2O3):m(Cu)=1:1,故C正确;
D.由上述分析可知,混合物中只有二氧化硅,一定没有氧化铝,故D错误;
故选D.

【题目】下列有关物质的实验操作、现象及结论描述正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32– |
C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
A. A B. B C. C D. D
【题目】A,B,C为短周期元素,在周期表中所处的位置如表所示.
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数.
(1)写出B,C元素的名称、 .
(2)B位于元素周期表中第周期第族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是 , 质量为g,电解的总反应方程式为;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 .