题目内容
【题目】下列各组混合物中,可以用分液漏斗分离的是( )
A. 苯和水 B. 乙酸和乙醇 C. 酒精和水 D. 溴苯和苯
【答案】A
【解析】
A、苯和水不互溶,出现分层,所以能用分液漏斗分离,故A正确;
B、乙酸和乙醇能互溶,不分层,所以不能用分液漏斗分离,故B错误;
C、酒精和水能互溶,不分层,所以不能用分液漏斗分离,故C错误;
D、溴苯和苯互溶,不分层,所以不能用分液漏斗分离,故D错误;
综上所述,本题选A。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为_____。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填字母序号,下同).
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E. 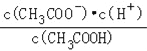
若升高该溶液温度(不考虑醋酸挥发),上述5种表达式的数据增大的是_____.
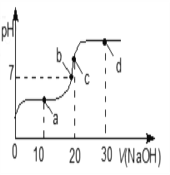
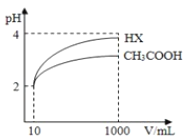
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c(H+),理由是_____.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____。