题目内容
1.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |
分析 若X为盐溶液,根据酸的酸性越弱,则对应盐的pH越大可知,X对应的酸的酸性比碳酸的酸性弱,若X为碱,则其碱性Ba(OH)2比弱.
解答 解:等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,X溶液的碱性大于碳酸氢钠,小于Ba(OH)2,
A、Na2CO3溶液的碱性大于碳酸氢钠,小于Ba(OH)2,故A不选;
B、根据酸的酸性越弱,则盐的pH越大可知,X对应的酸的酸性比碳酸的酸性弱,而硅酸的酸性比碳酸弱,故硅酸钠溶液符合,不B不选;
C、等浓度的氢氧化钠的碱性强于碳酸氢钠,低于氢氧化钡,符合,故C不选;
D、亚硫酸氢钠溶液显示酸性,比碳酸氢钠的碱性弱,不符合,故D选.
故选D.
点评 本题考查了盐的水解,注意把握盐溶液pH的判断方法:酸的酸性越弱,则盐的pH越大,题目难度不大.

练习册系列答案
相关题目
11.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
12.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳. 该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)═H2O(1)+CO2(g)+2H+(aq)+2e - | |
| B. | O2(g)+4H+(aq)+4e -═2H2C(1) | |
| C. | CH3OH(g)+H2O(1)═CO2(g)+6H+(aq)+6e - | |
| D. | O2(g)+2H2O(1)+4e -═4OH - |
6.以下除杂方案不正确的是( )
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
13.下列说法不正确的是( )
| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和麦芽糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
10.用固体样品配制一定物质的量浓度的溶液,下列图示对应的有关操作规范的是( )
| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
11.下列物质既能与金属钠作用放出气体,又能与纯碱作用放出气体的是( )
| A. | C2H5OH | B. | H2O | C. | CH3COOH | D. | C6H6 |
 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为 ,B在周期表中的位置第三周期第VA族,C的离子结构示意图为
,B在周期表中的位置第三周期第VA族,C的离子结构示意图为 .
.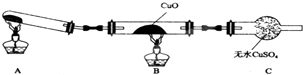 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.