题目内容
14.有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y$\stackrel{M}{→}$乙酸乙酯,下列说法不正确的是( )| A. | X可用新制的氢氧化铜悬浊液检验 | |
| B. | 实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯 | |
| C. | 乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种 | |
| D. | Y分子中含有3种不同环境的氢,峰面积比为3:2:1 |
分析 淀粉水解生成葡萄糖,葡萄糖在酒化酶的作用下分解生成乙醇,乙醇可与乙酸反应生成乙酸乙酯.
解答 解:分析上述转化关系:淀粉水解生成葡萄糖,葡萄糖在酒化酶的作用下分解生成乙醇,乙醇可与乙酸反应生成乙酸乙酯.
A.葡萄糖含有醛基,可用新制的氢氧化铜检验,故A正确;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层,则选饱和Na2CO3溶液,故B正确;
C.对于羧酸而言,根据羧基位置异构可以得到两种丁酸;根据酯基位置异构和碳链异构可得:甲酸丙酯2种(丙基2种异构)、乙酸乙酯1种、丙酸甲酯1种,共4种,故C错误;
D.Y分子为乙醇,分子中含有3种不同环境的氢,峰面积比为3:2:1,故D正确.
故选C.
点评 本题考查有机物的推断和性质、同分异构体的种类等知识,难度不大,有机物的推断为解题的关键,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,但要注意按照一定的顺序书写同分异构体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 取50mL 18.0mol/L浓硫酸与足量的铜片反应,生成气体分子的数目为0.45NA | |
| C. | 1L 0.1 mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA | |
| D. | 53.5gNH4Cl中存在的共价键总数为5NA |
2.为了改善空气质量,下列措施不合理的是( )
| A. | 倡导绿色化学理念,努力实现“原子经济” | |
| B. | 控制城市机动车保有量,实行机动车限号行驶 | |
| C. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| D. | 减少化石能源的使用,大力发展太阳能、风能等新能源 |
9.下表列出了①~⑨九种元素在周期表中的位置.
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是F(填元素符号).
(2)元素⑧的原子结构示意图是 .
.
(3)元素②、⑧的气态氢化物的稳定性较强的是CH4(填化学式);元素⑥、⑦的最高价氧化物对应的水化物的碱性较强的是NaOH(填化学式).
(4)②、③、⑧三种元素的原子半径由大到小的顺序是Si>C>N(填元素符号).
(5)元素⑤、⑥组成的化合物的化学键类型是离子键.
(6)元素⑥的最高价氧化物对应的水化物与元素⑨的氢化物溶于水形成的溶液反应的离子方程式是H++OH-=H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①~⑨九种元素中非金属性最强的是F(填元素符号).
(2)元素⑧的原子结构示意图是
 .
.(3)元素②、⑧的气态氢化物的稳定性较强的是CH4(填化学式);元素⑥、⑦的最高价氧化物对应的水化物的碱性较强的是NaOH(填化学式).
(4)②、③、⑧三种元素的原子半径由大到小的顺序是Si>C>N(填元素符号).
(5)元素⑤、⑥组成的化合物的化学键类型是离子键.
(6)元素⑥的最高价氧化物对应的水化物与元素⑨的氢化物溶于水形成的溶液反应的离子方程式是H++OH-=H2O.
3.在铁质品上镀上一定厚度的锌层,以下电镀方案正确的是( )
| A. | 锌作阳极,铁制品作阴极,溶液中含Zn2+ | |
| B. | 锌作阳极,铁制品作阴极,溶液中含Fe3+ | |
| C. | 锌作阴极,铁制品作阳极,溶液中含Zn2+ | |
| D. | 锌作阴极,铁制品作阳极,溶液中含Fe3+ |
 有如下性质:
有如下性质: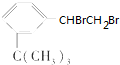 .
.
 CO+3H2.
CO+3H2.