题目内容
5.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 取50mL 18.0mol/L浓硫酸与足量的铜片反应,生成气体分子的数目为0.45NA | |
| C. | 1L 0.1 mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA | |
| D. | 53.5gNH4Cl中存在的共价键总数为5NA |
分析 A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
B、铜只能与浓硫酸反应,和稀硫酸不反应;
C、碳酸根的水解会导致阴离子个数增多;
D、求出氯化铵的物质的量,然后根据1mol氯化铵中含4mol共价键来分析.
解答 解:A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为0.1mol,个数为0.1NA个,故A错误;
B、铜只能与浓硫酸反应,和稀硫酸不反应,故浓硫酸变稀后反应停止,即浓硫酸不能反应完全,则生成的气体分子个数小于0.45NA个,故B错误;
C、碳酸根的水解会导致阴离子个数增多,故溶液中的阴离子的个数多于0.1NA个,故C正确;
D、53.5g氯化铵的物质的量为1mol,而1mol氯化铵中含4mol共价键,故含4NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列说法正确的是( )
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
13.下列排序错误的是( )
| A. | 熔点由高到低:NaCl>Na-K合金>Na | |
| B. | 晶体的熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| C. | 晶体的硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体的晶格能由大到小:NaF>NaCl>NaBr>NaI |
20.卤族元素的单质和化合物很多,我们可以利用所学《物质结构与性质》的相关知识去认识和理解它们.
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
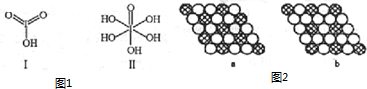
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
| 卤族元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |

(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
14.有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y$\stackrel{M}{→}$乙酸乙酯,下列说法不正确的是( )
| A. | X可用新制的氢氧化铜悬浊液检验 | |
| B. | 实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯 | |
| C. | 乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种 | |
| D. | Y分子中含有3种不同环境的氢,峰面积比为3:2:1 |
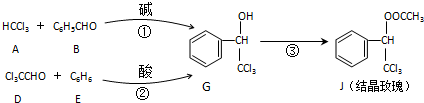

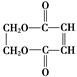 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: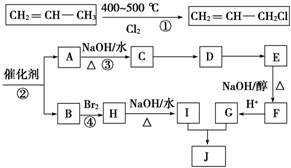
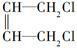 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$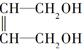 +2NaCl.
+2NaCl. ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).