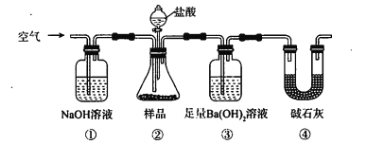
题目内容
【题目】 X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(1)元素X在元素周期表中的位置是_______。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_________,所含化学键的类型有离子键、____
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为________
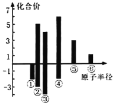
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为_______
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是_____,发生反应的离子方程式是_____________
【答案】第2周期IVA族 ![]() 共价键 H—O—H S(硫) 产生白色沉淀 H2SO3+2OH-+Ba2+=BaSO3↓ +2H2O或SO2+2OH-+Ba2+=BaSO3↓ +H2O
共价键 H—O—H S(硫) 产生白色沉淀 H2SO3+2OH-+Ba2+=BaSO3↓ +2H2O或SO2+2OH-+Ba2+=BaSO3↓ +H2O
【解析】
X、Y、Z、Q、W、R是常见的短周期主族元素,X的一种同位素被用作相对原子质量的标准,则X为C元素;常温下,Y元素的单质为双原子分子,分子中含有3对共用电子对,则Y为N元素;Z是短周期中(除稀有气体外)原子半径最大的元素,则Z为Na元素;Q的最外层电子数是次外层电子数的3倍,则Q为O元素;W的原子序数等于X、Y原子序数之和,则W的原子序数为13,则W为Al元素;R与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化,则R为S元素,据此分析解答。
由以上分析知,X为C元素,Y为N元素,Z为Na元素,Q为O元素,W为Al元素,R为S元素,
(1)X为C元素,其在元素周期表中的位置是第2周期IVA族;
(2)该固体化合物由2种元素组成,呈淡黄色,则该化合物为Na2O2,Na2O2是离子化合物,由钠离子和过氧根离子构成,其电子式是![]() ,所含化学键的类型有离子键、共价键;
,所含化学键的类型有离子键、共价键;
(3)元素的非金属性越强,其简单氢化物越稳定,O的非金属性最强,故稳定性最强的化合物为H2O,其结构式为H—O—H;
(4)元素④的最高正化合价为+6价,最低负化合价为-2价,O元素无最高正价,故④对应的元素为S(硫);
(5)将SO2通入BaCl2溶液中,不发生反应,没有明显变化,再向其中加入NaOH,NaOH与SO2反应生成Na2SO3,Na2SO3再与BaCl2发生复分解反应生成BaSO3白色沉淀,发生反应的离子方程式是H2SO3+2OH-+Ba2+=BaSO3↓ +2H2O或SO2+2OH-+Ba2+=BaSO3↓ +H2O。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】数十亿年来,地球上的物质不断的变化,大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分,用下表涉及的分子回答下列问题。
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
目前空气的主要成分 | N2、O2、CO2、水蒸气、稀有气体(He、Ne等) |
(1)含有非极性共价键的分子是______(填化学式)
(2)含有极性共价键的非极性分子是______(填化学式)
(3)H2O中心原子的杂化方式及分子构型为______
(4)图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物。其中代表CH4的是______(填字母序号)

(5)根据NH3H2ONH4++OH-,用氢键表示式写出氨分子和水分子之间最主要存在的氢键形式______