题目内容
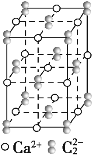
【题目】已知反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
A.KNO3是氧化剂,KNO3中N元素被氧化
B.生成物中的Na2O是氧化产物,K2O是还原产物
C.每转移1mole﹣,可生成标准状况下N2的体积为35.84升
D.若有65gNaN3参加反应,则被氧化的N的物质的量为3.2mol
【答案】C
【解析】
10NaN3+2KNO3═K2O+5Na2O+16N2↑中,N元素的化合价由![]() -价升高为0,N元素的化合价由+5价降低为0,该反应转移10e-,以此来解答。
-价升高为0,N元素的化合价由+5价降低为0,该反应转移10e-,以此来解答。
A.、KNO3中N元素的化合价降低,为氧化剂,其中氮元素被还原,故A错误;
B、只有N元素的化合价变化,则N2是氧化产物,也是还原产物,故B错误;
C、由反应可知转移10mol电子生成16mol氮气,则每转移1 mol电子,可生成N2为1.6mol,标准状况下N2的体积为35.84L,故C正确;
D、若有65 g NaN3参加反应,则被氧化的N的物质的量为![]() ,故D错误;
,故D错误;
故选 C。

 天天练口算系列答案
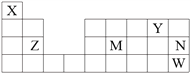
天天练口算系列答案【题目】 X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(1)元素X在元素周期表中的位置是_______。
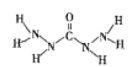
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_________,所含化学键的类型有离子键、____
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为________
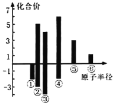
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为_______
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是_____,发生反应的离子方程式是_____________