题目内容
3.如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)?CH3OH(g)+H2O(g).实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示: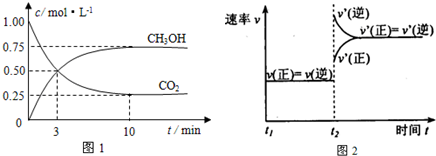
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min).500℃达平衡时,CH3OH(g)的体积分数为30%,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为放热反应(填“放热”或“吸热”).
(2)下列措施中不能使CO2的转化率增大的是BD.
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(3)下列措施能使n(CH3OH)/n(CO2)增大的是CD.
A.升高温度 B.恒容充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
E.恒压充入1molHe.
分析 (1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,据此计算;先根据浓度变化计算平衡时各物质的浓度,CH3OH的体积分数等于甲醇的物质的量浓度与总物质的量浓度之比;根据升高温度平衡向吸热反应方向移动判断;
(2)要提高CO2的转化率,应使平衡向正反应方向移动,根据平衡移动原理结合选项判断;
(3)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动.
解答 解:(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•mon);
开始时c(CO2)=1mol/L、c(H2)=3mol/L,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,则c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,CH3OH的体积分数等于甲醇的物质的量浓度与总物质的量浓度之比,所以甲醇的体积分数=$\frac{0.75mol/L}{(0.25+0.75+0.75+0.75)mol/L}$×100%=30%
根据图象知,升高温度,逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应是放热反应;
故答案为:0.225mol/(L•min);30%;放热;
(2)A.在原容器中再充入1mol H2,平衡向正反应方向移动,CO2的转化率增大,故正确;
B.在原容器中再充入1molCO2CO2的转化率反而减小,故错误;
C.缩小容器的容积即增大压强,平衡向正反应方向移动,CO2的转化率增大,故正确;
D.使用更有效的催化剂,平衡不移动,CO2的转化率不变,故错误;
E.将水蒸气从体系中分离出,平衡向正反应方向移动,CO2的转化率增大,故正确;
故答案为:BD;
(3)要使则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.恒容充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正确;
D.缩小容器容积,增大压强,平衡向正反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确;
E.恒压充入1molHe,为保持恒压体积增大,压强减小平衡逆向进行,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故E错误;
故答案为:CD.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度中等,注意根据图象计算各物质的平衡浓度为解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
| A. | 用水冲洗泄露的浓硫酸 | B. | 将熟石灰撒在泄露的浓硫酸上 | ||
| C. | 将氧化钡撒在泄露的浓硫酸上 | D. | 用土将泄露的浓硫酸掩埋 |
| A. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 家庭中不宜用铝合金容器长期存放咸的食品 | |
| C. | 水处理常用到明矾和漂白粉,但二者的作用原理不同 | |
| D. | 黄河入海口沙洲的形成体现了胶体聚沉的性质 |
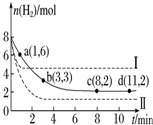 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
| A. | 反应CaO+H2O═Ca(OH)2能放出大量的热,故可通过原电池实现该反应,并把化学能转化为电能 | |
| B. | 在原电池或电解池装置中,都可实现反应:Cu+2H+═Cu2++H2 | |
| C. | 若原电池的两极是活泼性不同的两种金属,则活泼的金属不一定做负极 | |
| D. | 在钢铁制品上镶嵌锌块构成原电池以防治钢铁生锈,这种防护方法叫外加电源阴极保护法 |
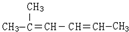 名称为:2-甲基-2,4-己二烯;
名称为:2-甲基-2,4-己二烯; ,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
 .
.