��Ŀ����
��һ���¶��£���2molA��2molB���������Ϸ������Ϊ2L���ܱո��������У��������·�Ӧ��3A��g��+B��g��?xC��g��+2D��g��2minĩ��Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.4mol?L-1��ش�
��1��x��ֵΪ ��
��2��A��ת����Ϊ����A��%= ��
��3�����¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
��4������ͬ���������£���ʼʱ����C��D ��
mol��Ҫʹƽ��ʱ�����ʵ����ʵ���������ƽ����ͬ����Ҫ���� mol ���ʣ�
��1��x��ֵΪ
��2��A��ת����Ϊ����A��%=
��3�����¶��¸÷�Ӧ��ƽ�ⳣ��K=
��4������ͬ���������£���ʼʱ����C��D ��
| 4 |
| 3 |
���㣺��ѧƽ��ļ���
ר�⣺��ѧƽ��ר��
��������1��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����n��D���������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
��2������ƽ��ʱn��D�����ɷ���ʽ��֪�μӷ�Ӧ��n��A��=
n��D�����ٸ���ת���ʶ������A��ת���ʣ�
��3��ƽ�ⳣ��ָָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ����������ʽ�����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��4���ɣ�1����֪��Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ��ݴ��ж�Ӧ��������ʼ������ʵ������ʵ�����
��2������ƽ��ʱn��D�����ɷ���ʽ��֪�μӷ�Ӧ��n��A��=
| 3 |
| 2 |
��3��ƽ�ⳣ��ָָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ����������ʽ�����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��4���ɣ�1����֪��Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ��ݴ��ж�Ӧ��������ʼ������ʵ������ʵ�����
���
�⣺��1��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����0.8mol��0.8mol=x��2�����x=2��
�ʴ�Ϊ��2��
��2��ƽ��ʱn��D��=0.8mol���ɷ���ʽ��֪�μӷ�Ӧ��n��A��=
n��D��=
��0.8mol=1.2mol����A��ת����Ϊ
��100%=60%��
�ʴ�Ϊ��60%��
��3����������ʽ����ƽ��ʱ������ֵ�Ũ��Ϊ��
3A��g��+B��g��?2C��g��+2D��g��
��ʼ��mol/L����1 1 0 0
�仯��mol/L����0.6 0.2 0.4 0.4
ƽ�⣨mol/L����0.4 0.8 0.4 0.4
��ƽ�ⳣ��k=
=0.5��
�ʴ�Ϊ��0.5��
��4���÷�Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ���ʼ����C��D��
mol���ɻ�ѧ����ʽ3A��g��+B��g��?2C��g��+2D��g����֪ת������ߣ����Եõ�AΪ
mol��
=2mol���õ�BΪ
mol��
=
mol���ʻ���Ҫ����B������B�����ʵ���Ϊ2mol-
mol=
mol��
�ʴ�Ϊ��
��B��
�ʴ�Ϊ��2��
��2��ƽ��ʱn��D��=0.8mol���ɷ���ʽ��֪�μӷ�Ӧ��n��A��=
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
�ʴ�Ϊ��60%��
��3����������ʽ����ƽ��ʱ������ֵ�Ũ��Ϊ��
3A��g��+B��g��?2C��g��+2D��g��
��ʼ��mol/L����1 1 0 0
�仯��mol/L����0.6 0.2 0.4 0.4
ƽ�⣨mol/L����0.4 0.8 0.4 0.4
��ƽ�ⳣ��k=
| 0��42��0��42 |
| 0��43��0.8 |
�ʴ�Ϊ��0.5��
��4���÷�Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ���ʼ����C��D��
| 4 |
| 3 |
| 4 |
| 2 |
| 3 |
| 2 |
| 4 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 4 |
| 3 |
�ʴ�Ϊ��
| 4 |
| 3 |
���������⿼�黯ѧ��Ӧ���ʡ���ѧƽ���ƶ�����ѧƽ����㡢��ѧƽ�ⳣ���ȣ��Ѷ��еȣ�ע�����֪ʶ�����գ�

��ϰ��ϵ�д�
�����Ŀ
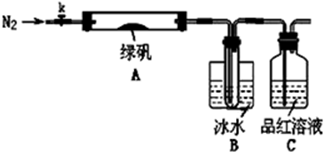
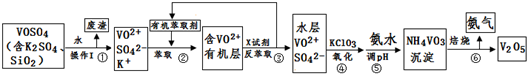
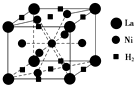 Ŀǰ�����ý�����Ͻ�����о���ȡ�úܴ��չ����ͼ��һ�������Ͻ����ľ����ṹͼ��
Ŀǰ�����ý�����Ͻ�����о���ȡ�úܴ��չ����ͼ��һ�������Ͻ����ľ����ṹͼ��