题目内容
1.按要求写出对应的方程式:(1)H++HCO3-=H2O+CO2↑(写出符合该离子反应的两种不同类型的化学方程式)
HCl+NaHCO3=NaCl+H2O+CO2↑;NaHSO4+NaHCO3=Na2SO4+H2O+CO2↑.
(2)KHSO4在水溶液中的电离方程式:KHSO4=K++H++SO42-.
(3)足量碳酸氢钙和饱和石灰水反应的离子方程式:Ca2++HCO3-+OH-=H2O+CaCO3↓.
分析 (1)H++HCO3-=H2O+CO2↑可以表示强酸与碳酸氢盐反应生成可溶性盐和二氧化碳和水,也可以表示可溶性强酸的酸式盐与碳酸氢盐反应生成可溶性盐和二氧化碳和水;
(2)硫酸氢钾为强电解质,在水溶液中完全电离生成钾离子、氢离子和硫酸根离子;
(3)二者反应生成碳酸钙和水;
解答 解:(1)H++HCO3-=H2O+CO2↑可以表示强酸与碳酸氢盐反应生成可溶性盐和二氧化碳和水,如盐酸和碳酸氢钠的反应,方程式:HCl+NaHCO3=NaCl+H2O+CO2↑,也可以表示可溶性强酸的酸式盐与碳酸氢盐反应生成可溶性盐和二氧化碳和水,如硫酸氢钠与碳酸氢钠的反应,方程式:NaHSO4+NaHCO3=Na2SO4+H2O+CO2↑;
故答案为:HCl+NaHCO3=NaCl+H2O+CO2↑、NaHSO4+NaHCO3=Na2SO4+H2O+CO2↑
(2)硫酸氢钾为强电解质,在水溶液中完全电离生成钾离子、氢离子和硫酸根离子,电离方程式:KHSO4=K++H++SO42-,
故答案为:KHSO4=K++H++SO42-;
(3)足量碳酸氢钙和饱和石灰水反应的离子方程式:Ca2++HCO3-+OH-=H2O+CaCO3↓;
故答案为:Ca2++HCO3-+OH-=H2O+CaCO3↓;
点评 本题考查了离子方程式书写,明确离子反应实质及离子方程式书写方法是解题关键,题目难度不大,注意化学式拆分和电荷守恒规律.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.由A、B、C、D四种金属按下表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-=Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
| 装置 | 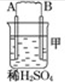 | 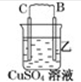 | 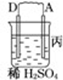 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-=Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
9.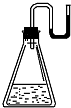 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
16.己知丙烷的燃烧热△H=-2200KJ•mol-1,若一定量的丙烷(C3H8)完全燃烧后生成18g水,则放出的热量约为( )
| A. | 55 kJ | B. | 220 kJ | C. | 1108 kJ | D. | 550 kJ |
13.下列说法正确的是( )
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 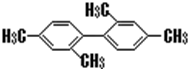 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 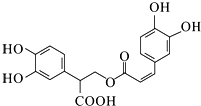 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
10.图中,表示正反应是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝和盐酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
 中学化学中有很多物质可以实现图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.
中学化学中有很多物质可以实现图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.