题目内容
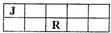 (2013?芜湖模拟)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2013?芜湖模拟)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )分析:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素,根据元素周期律的递变规律解答该题.
解答:解:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素.
A.J为C元素,和H元素组成的化合物烃中C-H键为极性键,C-C键,C═C,C≡C为非极性键,故A错误;
B.AlCl3为共价化合物,熔融状态下不导电,工业冶炼应用Al2O3,故B正确;
C.R应为S元素,T为Cl元素,同周期元素中,从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故T对应的氢化物更稳定,故C正确;
D.T的非金属性最强,最高化合价为+7价,对应的最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确.
故选A.
A.J为C元素,和H元素组成的化合物烃中C-H键为极性键,C-C键,C═C,C≡C为非极性键,故A错误;
B.AlCl3为共价化合物,熔融状态下不导电,工业冶炼应用Al2O3,故B正确;
C.R应为S元素,T为Cl元素,同周期元素中,从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故T对应的氢化物更稳定,故C正确;
D.T的非金属性最强,最高化合价为+7价,对应的最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确.
故选A.
点评:本题考查位置、结构、性质的相互关系及应用,难度中等,注意B中AlCl3为共价化合物,熔融状态下不导电,工业冶炼应用Al2O3.

练习册系列答案
相关题目



 或
或 或
或 或
或
