题目内容
(2013?芜湖模拟)氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应,用CuSO4溶液和“某物质”在40-50℃时反应可产生它.下列有关叙述中错误的是( )
分析:A、根据在该反应中,铜的化合价降低,“某物质”中元素的化合价必升高;
B、CuH中-1价的H可以与盐酸中+1价氢发生归中反应;
C、根据CuH具有还原性,与硝酸发生氧化还原反应;
D、根据氯气的强氧化性;
B、CuH中-1价的H可以与盐酸中+1价氢发生归中反应;
C、根据CuH具有还原性,与硝酸发生氧化还原反应;
D、根据氯气的强氧化性;
解答:解:A、因在该反应中,铜的化合价降,则“某物质”中元素的化合价必升高,体现了还原性,故A正确;
B、因CuH中-1价的H可以与盐酸中+1价氢发生归中反应:CuH+HCl═CuCl+H2↑,故B正确;
C、因CuH具有还原性,与硝酸发生氧化还原反应:CuH+3HNO3=Cu(NO3)2+NO↑+2H2O,离子方程式:CuH+3H++NO3-=Cu2++NO↑+2H2O,故C正确;
D、因氯气的具有强氧化性,能够将+1价的铜氧化成+2价:2CuH+3Cl2=2CuCl2+2HCl,故D错误;
故选:D.
B、因CuH中-1价的H可以与盐酸中+1价氢发生归中反应:CuH+HCl═CuCl+H2↑,故B正确;
C、因CuH具有还原性,与硝酸发生氧化还原反应:CuH+3HNO3=Cu(NO3)2+NO↑+2H2O,离子方程式:CuH+3H++NO3-=Cu2++NO↑+2H2O,故C正确;
D、因氯气的具有强氧化性,能够将+1价的铜氧化成+2价:2CuH+3Cl2=2CuCl2+2HCl,故D错误;
故选:D.
点评:本题主要考查了学生根据信息,联系旧知识解决问题的能力,培养了学生分析问题的能力.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
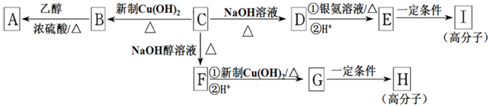



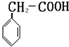 或
或 或
或 或
或
